湖南大学王柯敏/黄晋团队Nano Lett.:可控自组装和循环解组装的DNA纳米球用于细胞内miRNA放大成像
细胞内microRNA(miRNA)的可视化对于揭示其在疾病发展中的作用具有重要意义。然而,细胞膜屏障、复杂的细胞内环境和低丰度的靶标是细胞内miRNA高效成像的三大挑战。为了应对这些挑战,近日,湖南大学王柯敏/黄晋团队在Nano Letters 期刊发表研究论文,报道了一种尺寸可控的自组装DNA纳米球,该DNA纳米球具有良好的细胞穿透性和稳定性,并利用细胞内源性小分子ATP作为燃料驱动DNA纳米球的循环解组装,实现“一对多”信号检测模式用于活细胞内和小鼠体内低丰度miRNA的放大成像。该论文第一作者为王姣丽,通讯作者为黄晋教授。
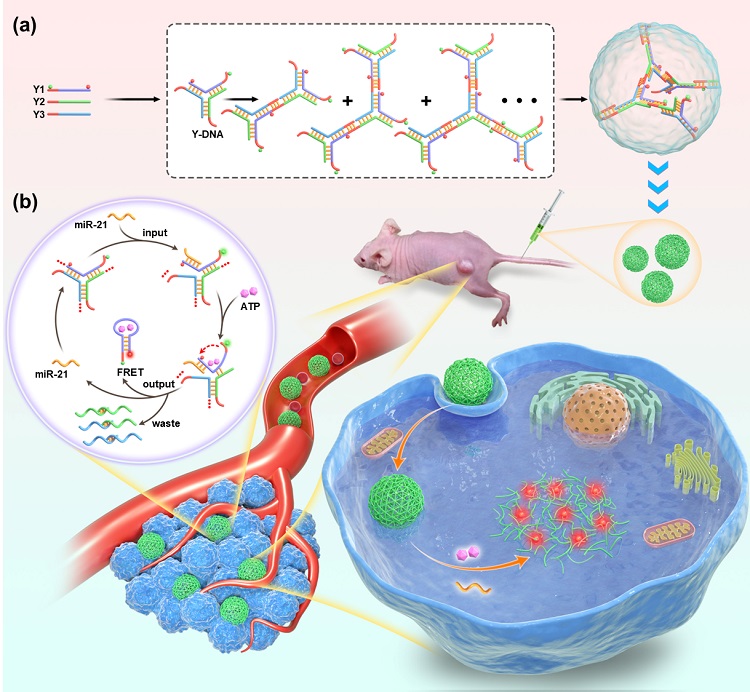
图1. DNA纳米球的自组装和解组装示意图。(a)DNA纳米球的组装过程;(b)在ATP的作用下,细胞内的miRNA触发DNA纳米球的循环解组装。
该核酸纳米球的组装过程如图1a所示,核酸纳米球由Cy5-Y1-Cy3、Y2、Y3自组装形成。其中,每条链都包含一段红色的“粘性末端”片段(回文序列),Y1的5’和3’末端分别标记荧光供体Cy3和荧光受体Cy5,纳米球结构的形成使Cy3和Cy5分开,此时产生的FRET信号低。DNA纳米球中Y1包含miR-21的互补序列和ATP的核酸适配体,其中适配体部分完全被封闭,中间暴露一段miR-21的单链识别区域。解离过程如图1b所示,当目标物miR-21存在时,miR-21与Y1中miR-21的单链识别区域结合发生链置换反应,使得ATP的适配体部分从刚性较强的Y-DNA中释放下来,进而与ATP特异性结合发生构型转变,从亚稳态双链转变为稳定的发夹结构同时释放miR-21。此时,发夹结构的形成拉近了荧光供体Cy3和荧光受体Cy5,从而有效地发生荧光共振能量转移,产生FRET信号。释放的miR-21能够与相邻的Y-DNA进一步杂交进行下一轮的循环反应。通过这种目标物循环的方式,最终使DNA纳米球完全解组装,从而实现miRNA的高灵敏检测。
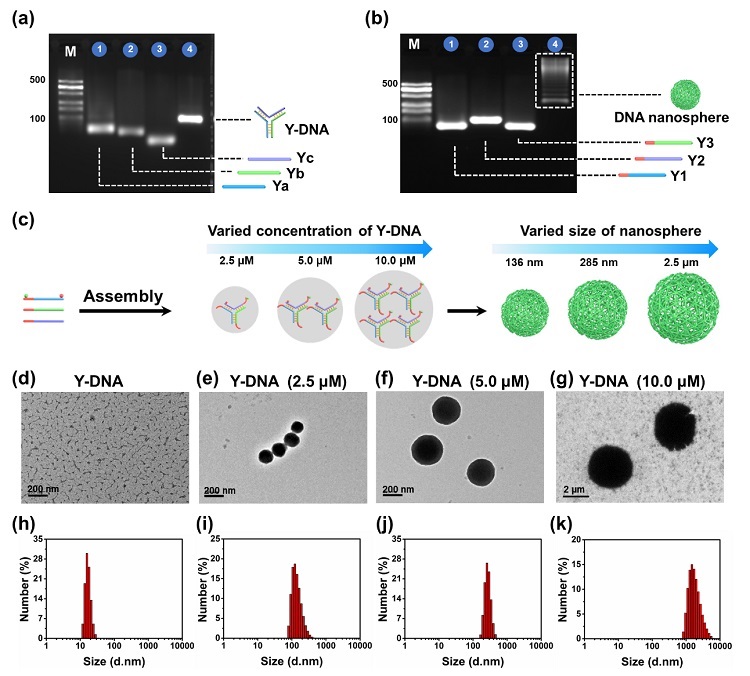
图2. DNA纳米球的制备与表征。(a)Y-DNA的琼脂糖电泳表征;(b)DNA纳米球的琼脂糖电泳表征;(c)不同浓度Y-DNA(2.5 μM、5.0 μM和10 μM)制备的DNA纳米球示意图。(d-g)Y-DNA(不含回文序列)与不同浓度Y-DNA制备DNA纳米球的投射电镜(TEM)表征图;(h-k)Y-DNA(不含回文序列)与不同浓度Y-DNA制备DNA纳米球的动态光散射(DLS)表征图。
上述结果表明,DNA纳米球的尺寸大小随着Y-DNA组装浓度的增加而变大,意味着高浓度Y-DNA有利于制备更大尺寸的核酸纳米球。

图3. ATP驱动DNA纳米球的解组装用于试管中miRNA的放大检测。(a)DNA纳米球解组装过程示意图;(b)DNA纳米球解组装的琼脂糖电泳表征结果;(c)DNA纳米球的解组装的动态光散射(DLS)表征结果;(d)DNA纳米球的解组装的透射电镜(TEM)表征结果;(e)DNA纳米球在不同条件下的FRET信号动力学考察结果。(f)DNA纳米球在10 mM ATP存在的情况下,体系与不同浓度miR-21孵育后的荧光光谱图。DNA纳米球体系产生的FRET信号与miR-21的浓度呈正相关关系,经计算,检测限为36.0 pM,表明DNA纳米球可用于低丰度miRNA的放大检测。(g)与靶标miR-21孵育的DNA纳米球体系产生的FRET信号明显高于其他非目标miRNA,表明DNA纳米球具有良好的检测特异性。
上述结果表明,在燃料分子ATP的作用下,目标miRNA能够特异性地触发DNA核酸纳米球发生快速解组装。
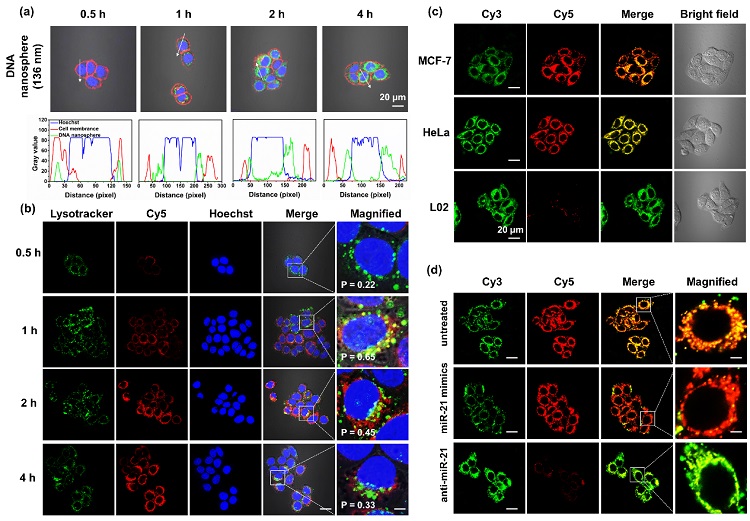
图4. DNA纳米球用于活细胞内miRNA的放大成像。(a)DNA纳米球与MCF-7细胞孵育不同时间的共聚焦成像结果;随着孵育时间的延长,越来越多的DNA纳米球进入细胞。(b)内化后的DNA纳米球与溶酶体的共定位情况;内化后的DNA纳米球与溶酶体的共定位系数先增后减,意味着越来越多的DAN纳米球从溶酶体中逃逸出来。(c)DNA纳米球与MCF-7、HeLa和L02细胞孵育后的共聚焦成像结果;DNA纳米球能够检测出不同细胞内miR-21表达水平的差异。(d)MCF-7预先通过脂质体转染分别用miR-21 mimics和anti-miR-21转染后,再与DNA纳米球孵育的共聚焦成像结果。转染miR-21 mimics后,细胞内产生了增强的FRET信号,而转染anti-miR-21的细胞内FRET信号显著降低。
上述结果表明,DNA纳米球具有较高的细胞内化效率,进入细胞后,该DNA纳米球能够成功从溶酶体中逃逸出来。并且,设计的DNA纳米球可以对活细胞内miRNA的表达水平变化作出正确的响应。
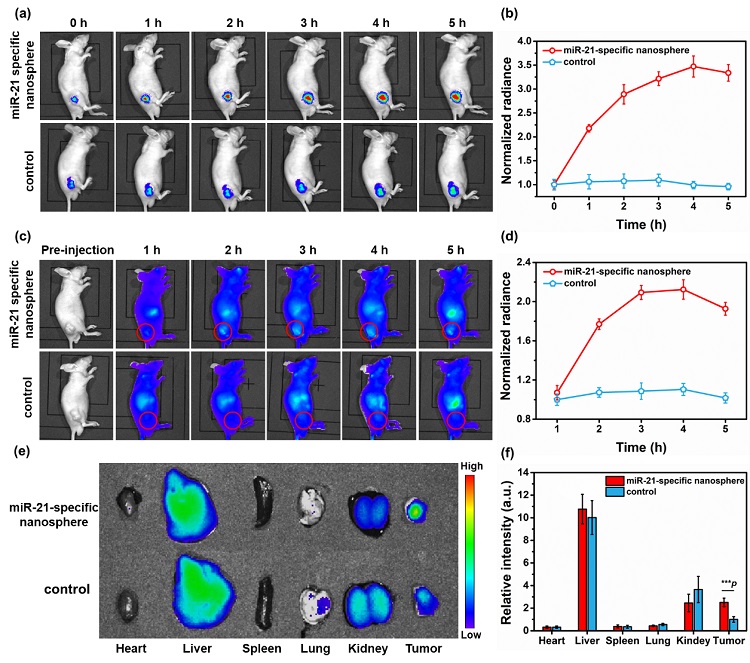
图5. DNA纳米球用于活体肿瘤内miRNA的放大成像。(a)小鼠分别通过瘤内注射DNA纳米球和对照DNA纳米球后的荧光成像结果;(b)为(a)图中的肿瘤内的荧光强度;(c)小鼠分别通过尾静脉注射DNA纳米球和对照DNA纳米球后的荧光成像结果;(d)为(c)图中的肿瘤内的荧光强度;(e)小鼠通过尾静脉注射探针4小时后采集的肿瘤和其他主要器官的荧光图像;(f)为(e)图中肿瘤与其他主要器官的相应荧光定量结果。
注射了特异性DNA纳米球的小鼠体内产生的荧光信号随着时间的延长逐渐增强,而对照组小鼠肿瘤部位无明显荧光信号的产生。肿瘤内荧光量化结果如图所示,随着时间的延长,肿瘤部位的荧光逐渐增强,在4 h时达到最大值。这些结果表明,DNA纳米球可以在老鼠体内实现目标miRNA的放大成像。
综上,本文设计了一种具有信号放大功能的DNA纳米球,该DNA纳米球以细胞内源性ATP作为燃料分子驱动靶标循环触发DNA纳米球的快速解组装,从而实现了活细胞内和小鼠体内miRNA的放大成像。该纳米球具有以下优点:(1)与传统方法相比,该核酸纳米球的设计更为简单,只需通过三种类型的短链核酸(Y1、Y2和Y3)进行自组装即可形成;(2)该纳米球利用细胞内源性的小分子ATP作为燃料,驱动目标物的循环利用,提高了检测灵敏度;(3)以FRET比率型信号作为输出信号,避免了细胞内的复杂环境对最终检测信号的干扰,提高了检测结果的准确度。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Size-Controllable and Self-Assemble DNA Nanosphere for Amplified MiRNA Imaging through ATP-Fueled Cyclic Dissociation
Jiaoli Wang, Juan Li, Yu Chen, Ruiting Liu, Yixuan Wu, Jianbo Liu, Xiaohai Yang, Kemin Wang, Jin Huang
Nano Lett., 2022, DOI: 10.1021/acs.nanolett.2c02934
作者介绍

黄晋,湖南大学教授,博士生导师,曾获湖南省杰出青年基金资助,入选教育部长江学者奖励计划(青年学者)。主要从事分析化学与生物医学等交叉学科领域的研究工作,在信号放大、细胞RNA成像、DNA机器以及分子诊断新方法研究方面积累了丰富经验,取得了阶段性进展。迄今已主持包括国家自然科学基金在内的科研项目10余项,参与国家自然科学基金重大项目和重点项目。在国际学术期刊上发表论文100多篇,包括Journal of the American Chemical Society, Angewandte Chemie International Edition, Nano Letters, ACS Nano, Nucleic Acid Research等。E-mail: jinhuang@hnu.edu.cn
王柯敏
https://www.x-mol.com/university/faculty/10117
黄晋
https://www.x-mol.com/university/faculty/66377
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号