级联胶束纳米探针调控实现特异蛋白冠招募,促进胶质瘤诊疗
注:文末有本文科研思路分析
胶束探针在胶质瘤监测和治疗方面等医学领域具有广阔的应用前景。然而胶束纳米探针进入活体时,体内蛋白会迅速与纳米颗粒表面结合,与血液中蛋白质分子形成的“蛋白冠”。“蛋白冠”的存在让纳米探针在体内的命运难以控制。那么,是否可以操控体内的蛋白,让蛋白冠成为胶束探针的保护伞呢?近日,北京理工大学王蔚芝(点击查看介绍)团队通过级联多肽,构筑了一种新型胶束探针,较好的实现了功能蛋白的利用以及对神经胶质瘤干细胞受体CD133的靶向。
近年来,纳米探针在癌症诊疗以及药物递送上受到广泛关注,实现高靶向率的协同性纳米探针成为研究的热点问题。然而,当纳米粒子进入到血液循环中,立刻会吸附体内的多种蛋白,形成蛋白冠,这会极大地阻碍靶向配体与受体的结合。另外,在脑瘤诊治中,血脑屏障的存在也会组织纳米探针的进入,这两点限制了纳米探针在脑胶质瘤方面的应用。
王蔚芝团队开发的级联胶束纳米探针对以上问题提出了新的研究思路。载脂蛋白E(ApoE)是一种血浆蛋白,主要在肝脏和脑组织中合成,具有指导脂质转运的功能。载脂蛋白可以与血脑屏障上过度表达的LDL(低密度脂蛋白)的特异性配体结合。因此,特异性招募ApoE 蛋白冠使得胶束探针可以通过受体介导的转胞吞作用 (RMT) 穿透血脑屏障并在循环中保持稳定。与此同时,CD133在胶质瘤的癌症干细胞(CSCs)中高表达,其靶向可用的细胞外结构域已被广泛认可。因此,本研究开发一款多肽修饰的级联胶束纳米探针,通过功能化分子调控实现了ApoE蛋白冠募集、血脑屏障穿透以及CD133靶向,从而实现肿瘤诊断和药物递送。
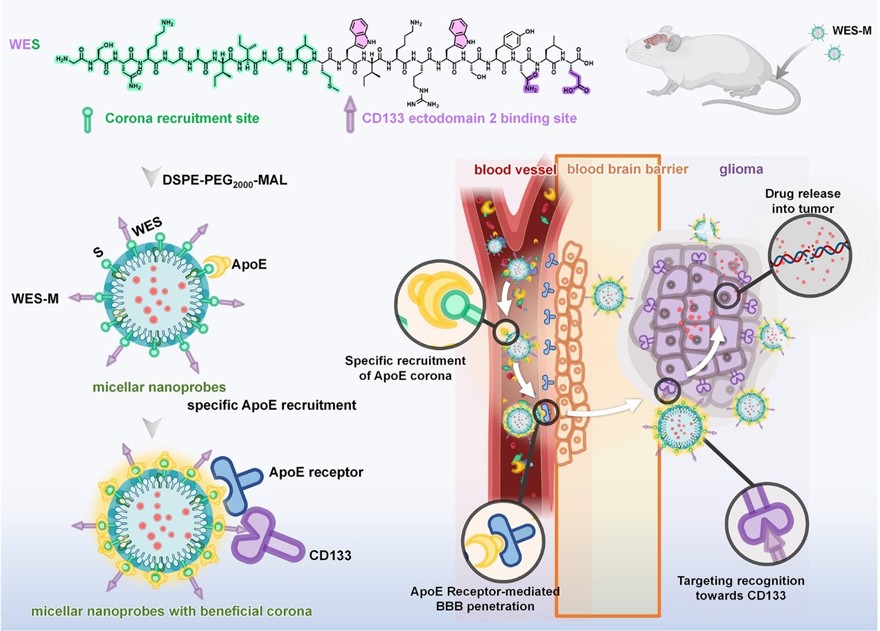
图1. 胶束探针的制备和智能胶束探针的体内循环
研究显示级联胶束纳米探针通过特异性吸附载脂蛋白E提高了血脑屏障穿透效率,靶向多肽的存在增强了对肿瘤干细胞的识别,该纳米胶束在胶质瘤细胞模型和小鼠模型里都体现了较好的治疗效果。鉴于这种功能性纳米探针系统表现出更高的稳定性和对脑肿瘤的靶向能力,可为胶质瘤的胶束纳米探针设计和构建提供新的策略。
这一成果近期发表在Analytical Chemistry 上,文章的第一作者是北京理工大学硕士研究生于姚,北京理工大学王蔚芝研究员和曹洁副教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Controlled Recognition and Corona Formation by Cascade Micellar Nanoprobes: for Boosting Glioma Theranostics
Yao Yu, Minxuan Wang, Mengzhen Li, Limin Zhang, Jinge Zhao, Jie Cao*, and Weizhi Wang*
Anal. Chem., 2022, 94, 11118–11123, DOI: 10.1021/acs.analchem.2c02501
导师介绍
王蔚芝
https://www.x-mol.com/groups/wang_weizhi
科研思路分析
Q:这项研究的想法是怎么产生的?
A:我们团队在微流控多肽筛选方面具有成熟的技术,对于CD133受体可以筛选到亲和力较强的靶向多肽,然而如何让这条多肽更好的发挥作用是我们一直在探索的问题。为了让纳米探针靶向性维持稳定,我们选择了一条天然的多肽和我们的多肽相互配合作用,形成了具有更高的稳定性和对脑肿瘤的靶向能力的纳米探针系统。
Q:研究过程中遇到哪些挑战?
A:最大的挑战是如何验证纳米探针系统在体内可以特异性招募载脂蛋白。在这个过程中,电镜与电泳的配合起了很关键的作用。
Q:该研究成果可能在哪些领域有重要的应用?
A:本研究通过级联多肽,为一种新型胶束探针的制备、优化和体内/体外评价提供了完整的参考,旨在更好地诊断、指导手术和治疗脑胶质瘤的选择。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




































 京公网安备 11010802027423号
京公网安备 11010802027423号