铜单原子催化剂在真实反应条件下的动态稳定性
单原子催化剂的长期稳定性是影响其大规模商业应用的一个主要因素。如何有效评估单原子催化剂在真实反应条件下的动态稳定性,目前还没有一个很好的解决方案。近日,东南大学王金兰(点击查看介绍)课题组和德克萨斯大学奥斯汀分校(UT Austin)刘远越(点击查看介绍)课题组通过恒定电势分子动力学方法详细地研究了铜单原子催化剂在真实反应条件下的动态稳定性。
自“单原子催化”的概念被首次提出以来,作为一种新的前沿催化材料,单原子催化剂(SACs)在近十年来受到了广泛关注。然而,在追求更好的活性和选择性的同时往往牺牲掉了材料的稳定性,这是阻碍它们大规模商业应用的一个关键因素。因此,有效评估SACs的稳定性是一个重要课题。有趣的是,近日多篇文献通过原位XAS表征技术揭示在反应前后(J. Am. Chem. Soc. 2022, 144, 27, 12062-12071; Nat. Energy 2020, 5, 623-632; Angew. Chem. Int. Ed. 2019, 58, 15098-15103),铜会保持原子分散态,但在反应过程中会形成超小的铜团簇作为瞬态活性位与电解质中的CO2结合,通过质子和电子转移完成CO2到乙醇的转化。这一可逆结构演变不禁让我们对“稳定性”的影响有了一个新的认识,但依然有很多问题没有解决,尤其是,为什么反应中铜会从表面浸出形成团簇?又为什么反应后铜团簇会恢复到铜单原子分散态呢?
针对上述问题,王金兰教授、刘远越教授等人采用恒定电势分子动力学方法,引入电荷和溶剂化效应,更加精确的模拟单原子的动态稳定性以及在真实反应条件下的动态结构演变。结果揭示氢的吸附是铜单原子从催化剂表面浸出的重要驱动力。随着电极电位越负,氢吸附越强,铜单原子越容易浸出。此时,与其他铜原子聚合形成铜小团簇能够作为真正催化活性中心促进CO2还原成乙醇。当反应结束,电极电位被切断或切换到正值,羟基自由基(OH•)能够促进铜团簇氧化,最后通过再沉积过程回到初始原子分散态,至此完成了对铜单原子催化剂动态稳定性的深入研究。接下来对全文进行详细的讲解:
1、单原子Cu浸出表面的可能性
作者选取了具有代表性的Cu-N4-C催化体系,首先从热力学出发,评估铜单原子浸出表面形成Cu2+(aq)的难易程度(图1a)。计算结果表明,虽然随着电极电势越负,Cu从表面浸出需要的能量在减小,但在U = −1.5 V下仍需克服2.09 eV的能量,说明这一过程在热力学上是非常不利的。再者,通过恒电势的分子动力学模拟,利用“slow-growth”方法对这一过程进行动力学评估(图1b),发现需要克服一个高达4.74 eV的能垒,再次证明Cu单原子很难从表面浸出形成Cu团簇。经过Bader电荷分析(图1d),一旦铜脱离表面,氧化态降低,会有形成Cu团簇的可能。

图1. 从热力学和动力学上评估Cu单原子浸出表面的可能性。
2、H 的吸附
从上述计算中获知Cu很难从表面浸出,这与实验上观测到Cu-Cu键的结果相矛盾。因此,作者猜测Cu的浸出可能与H的吸附有关,所以进一步从热力学和动力学方面考虑了H连续吸附在四个N位点上的难易程度。值得注意的是在U = −1.0 V时(图2a),H吸附的自由能正好接近于0 eV,对应析氢性能最好,与实验结果吻合的非常好。当应用的电极电势比−1.0 V更负时,H的吸附逐渐增强,导致氢气的产率下降。接下来评估了H吸附的动力学能垒,参考的电极电势是−1.2 V,这是因为实验在U = −1.2 V下获得了乙醇的最高法利第效率。从图2c和2d中可以看出,H的吸附在动力学上是非常有利的,室温下即可发生。
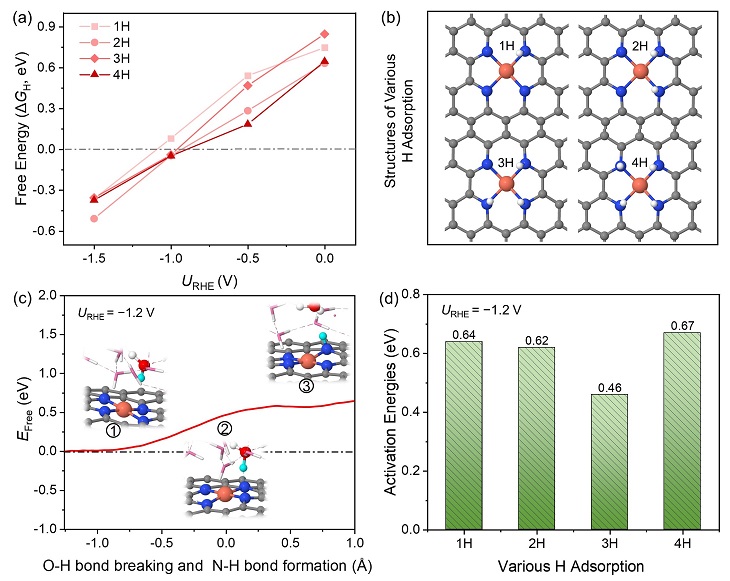
图2. 从热力学和动力学上评估H吸附在N位点上的难易。
3、H吸附情况下,单原子Cu浸出表面的可能性
在U = −1.2 V电极电势下,H吸附到N位点,且最高可达4个H同时吸附。因此,在有H吸附的情况下,作者对Cu的浸出过程重新进行了评估。图3a和3b表明H吸附的存在大大地降低了Cu从表面浸出所需的能量。令人惊奇的是,当表面H吸附大于两个时,Cu单原子能够自发的从表面浸出,与一个N原子配位(图3d)。他们进一步计算了Cu单原子完全溶解到溶液中需克服0.84 eV的能量。这一过程要比Cu不完全浸出慢一些,因此,在整个体系中存在两种状态的Cu,一是未完全浸出与表面一个N配位的Cu,另一个是完全溶解在溶液中与H2O分子的O配位的Cu。接下来他们尝试模拟两种状态的Cu能否聚合形成Cu团簇。从图3f中可以观察到,在模拟2.5 ps时,一个完全溶解的Cu与一个被表面栓住的Cu发生聚合形成Cu-Cu键,且一直保持。他们对这一过程进行了持续25 ps的动力学模拟,但遗憾的是没有观察到剩余两个溶解的Cu再次成键。由于计算成本的限制,作者不得不停止模拟,但在动态且复杂的界面,应该会有更多溶解的Cu原子发生聚合形成Cu小团簇促进CO2还原成乙醇。到此,作者采用恒电势分子动力学方法解决了Cu从表面浸出的问题。
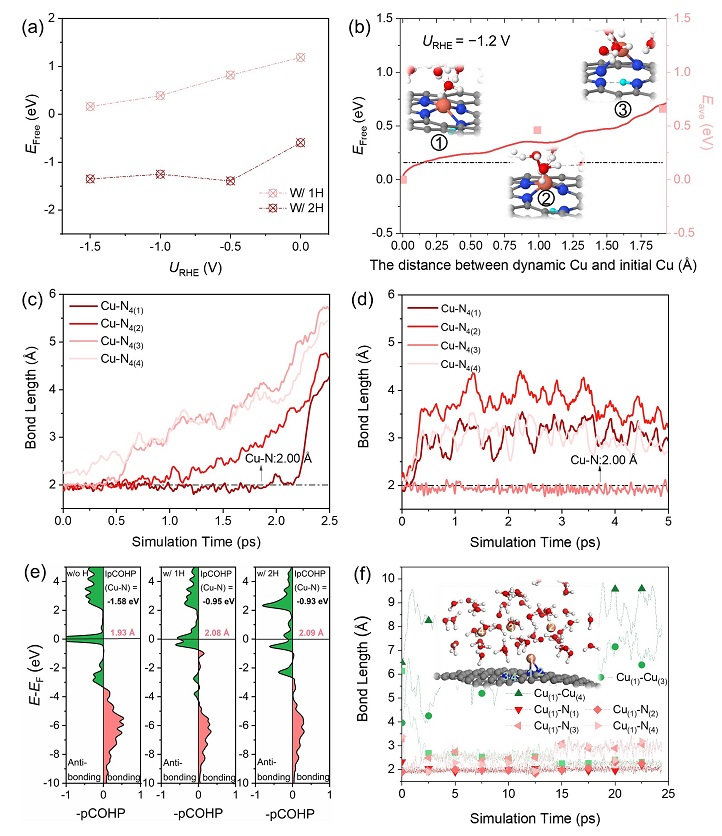
图3. 当N位点被H原子吸附之后,Cu单原子从表面浸出的可能性被评估。
4、Cu小团簇如何恢复到初始的单原子Cu分散态
接下来,研究的是Cu小团簇如何恢复到初始的Cu单原子的状态。这里,使用简单的Cu4和Cu SA-Cu3模型来描述铜团簇回归到单原子的热力学过程(图4a)。计算结果表明,随着电极电势的越正,释放的能量越多,说明反应越有利。进一步评估这一过程的动力学。最近,Cui等人报道了室温下在HCO3−溶液中能够形成高度氧化的羟基自由基(Nat. Commun. 2022, 13, 3694)。作者参考的实验里也是用到的HCO3−溶液(Angew. Chem. Int. Ed. 2019, 58, 15098-15103)。因此,在体系中引入两个OH•促进Cu团簇的氧化。从图4b可以看出,Cu团簇在2 ps以后发生溶解。相比于纯水溶液(1.09 eV),这一过程被大大地促进。当Cu团簇被氧化后,游离的Cu原子会与三个水分子配位。当漂移到N4-C位点附近时,发生再沉积过程,其中包括Cu与衬底的一个N配位和Cu完全回到N4-C平面两个过程,对应势垒分别为0.85和0.50 eV。到此,清楚地解释了高度氧化的OH•和强的N4-C螯合能力的协同作用促进了Cu团簇能够恢复到初始原子分散态。
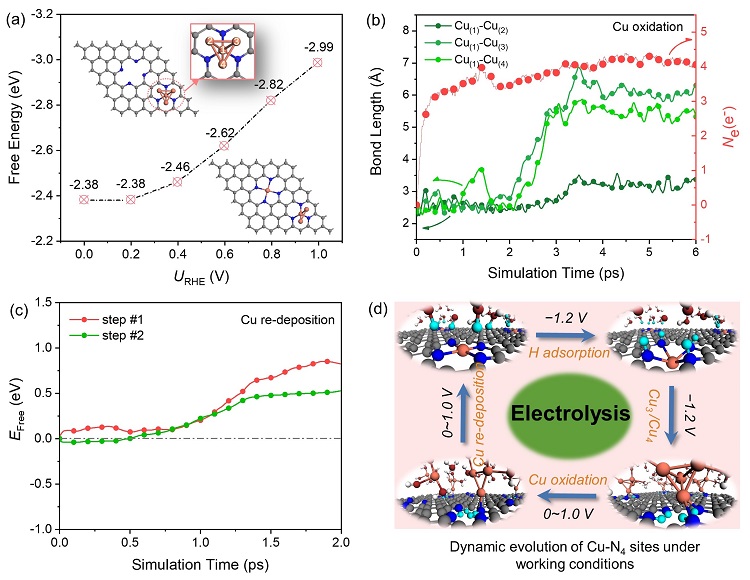
图4. Cu小团簇恢复到初始的原子分散态过程的探索。
综上所述,作者采用恒定电势分子动力学系统地研究了Cu单原子催化剂在工作条件下的动态稳定性,即Cu 单原子和Cu小团簇之间的可逆转变。他们揭示H的吸附是Cu单原子转化为Cu团簇的关键驱动力,而Cu团簇向原子分散状态的转变是由高度氧化的OH•和强的N4-C螯合能力共同主导。以上这些结果用传统的电中性DFT计算很难观察到。因此,考虑表面电荷和显性的溶剂环境的影响是深入理解在真实反应条件下SACs动态稳定性的重要手段。
这一成果近期发表在Journal of the American Chemical Society 上,文章的第一作者是东南大学物理学院白晓婉,UT Austin的赵训华博士为共同第一作者。东南大学的王金兰和UT Austin的刘远越为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dynamic Stability of Copper Single-Atom Catalysts under Working Conditions
Xiaowan Bai, Xunhua Zhao, Yehui Zhang, Chongyi Ling, Yipeng Zhou, Jinlan Wang*, and Yuanyue Liu*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c07178
导师介绍
王金兰
https://www.x-mol.com/university/faculty/31094
刘远越
https://www.x-mol.com/university/faculty/50201
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号