一种机械力增强的细菌黏附
为了实现在宿主体内的黏附和侵染,细菌进化出了一系列的黏附蛋白,用以适应和抵抗宿主体内不同的机械力环境。例如细菌需要在动脉、气管和尿道中的巨大流体剪切力中维持黏附。另外一方面,细菌也可以在微小机械力环境中可逆的断开这些黏附,实现在宿主体内的动态迁移。那么,细菌是如果通过黏附蛋白来同时实现这两个看似矛盾的功能和行为的呢?近日,新加坡国立大学物理系和力生物研究所的严洁教授(点击查看介绍)团队在单分子层面展示了机械力如何反常地去稳定和增强一类特殊的细菌黏附连接。
近年来,葡萄球菌属中的一类重要的细菌黏附分子(以SdrG蛋白为代表)被广泛地研究和报道。作为有史以来自然界中被发现的具有最强力学稳定性的可逆非共价相互作用,这一类细菌黏附分子具有媲美共价键的机械力学稳定性。例如,在被高速的拉伸时,单个SdrG蛋白和其配体分子之间的解离力能达到2纳牛左右,接近了共价化学键的强度。另一方面,在生化测量的零机械力环境下,这类细菌黏附又表现出相对比较弱的结合能力和动态的黏附。这一对看似十分矛盾的性质,一直困扰整个领域许多年。此外,在细菌黏附领域有一个长期存在的假说,有些细菌黏附中存在一种特殊的机械性能,在机械力逐渐增大的过程中黏附强度会反常的逐渐增强,学界把具有这一性质的键称作“catch bond”。在某种程度上,这种“catch bond”类似于汽车的安全带,在不受力时表现得十分松弛,而在感受到突然的拉力时反而会快速收紧。这一假说也许可以圆满的解释前面提到的细菌黏附分子在不同机械力下的矛盾的性质。然而,由于实验技术和手段的限制,这一假说一直没有得到直接验证。
严洁研究团队发展了可以实现皮牛量级内长时间测量的单分子磁镊技术,克服了这一技术壁垒,利用这一技术,黄文茂博士和合作者系统性地研究了这一家族的细菌黏附分子在小力范围内的机械力响应和行为。他们发现这些黏附分子在结合其对应的宿主受体分子时,都表现出显著的“catch bond”行为,具体的讲,其成键的寿命在外力升高到几十皮牛时会显著增长几千倍。他们还报道了这些细菌黏附分子的温度敏感性,将温度从室温23度提高到人体体温37度左右时,其成键寿命会降低100倍左右,在几个皮牛的范围内只有几秒钟寿命,这意味着在宿主生理环境下,这一细菌黏附既可以在小力或零力环境中实现动态黏附,而随着机械力的增加,这一动态黏附会迅速稳定,成为一个媲美共价键强度的生物分子相互作用。通过系统性地对SdrG突变种研究,他们还揭示了这一小力下的解离过程的转变途径,并且通过构建物理模型来定量的描述了观测到的“catch bond”行为。
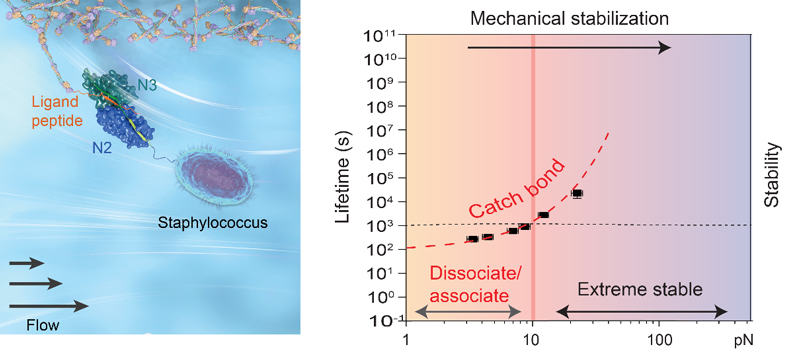
图1. 左图描述了一个球菌通过一个细菌黏附分子吸附在人体宿主内部的配体蛋白上;右图为这一反直觉的“catch bond”行为具体有随机械力增大的寿命。
这一成果近期发表在Journal of the American Chemical Society 上,文章的第一作者是新加坡国立大学黄文茂博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Mechanical Stabilization of a Bacterial Adhesion Complex
Wenmao Huang, Shimin Le, Yuze Sun, Dennis Jingxiong Lin, Mingxi Yao, Yi Shi, and Jie Yan*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c03961
导师介绍
严洁
https://www.x-mol.com/university/faculty/350827
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号