中山大学尹胜/王军舰团队JACS:高活性瑞香烷型二萜天然小分子靶向核转运蛋白importin-β1治疗去势抵抗型前列腺癌
前列腺癌是最常见的男性泌尿系统恶性肿瘤,发病率位居男性恶性肿瘤第二位,致死率排名第五,严重威胁着人类的健康。去势疗法是治疗早期前列腺癌的标准方式之一,但随着治疗的进程,该疾病终将发展为去势抵抗型前列腺癌(CRPC),是病人死亡的重要原因。目前临床治疗CRPC的一线药物为恩杂鲁胺和阿比特龙,由于获得性耐药的产生,在治疗后期往往收效甚微。因此,发现具有新机制能克服耐药的治疗药物具有重要意义。
近日,中山大学药学院尹胜教授(点击查看原文)团队与王军舰教授(点击查看介绍)团队合作在J. Am. Chem. Soc.杂志在线发表研究论文,从结构多样性大戟科二萜库中筛选获得一个在体内外具有强效抗CRPC的瑞香烷型二萜小分子DD1,并通过多种手段发现和证实其直接作用靶点为核转运蛋白importin-β1,首次揭示了importin-β1在CRPC进展中的功能及其作为药物靶点的可行性,为开发新型CRPC治疗药物提供了强效importin-β1类抑制剂。
研究人员对数年来积累的结构多样性大戟科二萜天然产物库(255个化合物,16类骨架)进行抗去势抵抗型前列腺癌(CRPC)活性筛选,发现了系列具有高活性的瑞香烷型二萜,其中化合物DD1活性最佳,对多株CRPC细胞IC50s ≈ 1 nM,且对正常细胞具有高选择性(SI>1000);DD1能够显著诱导CRPC细胞发生凋亡,减少细胞集落形成并抑制前列腺癌病人来源肿瘤类器官的生长。
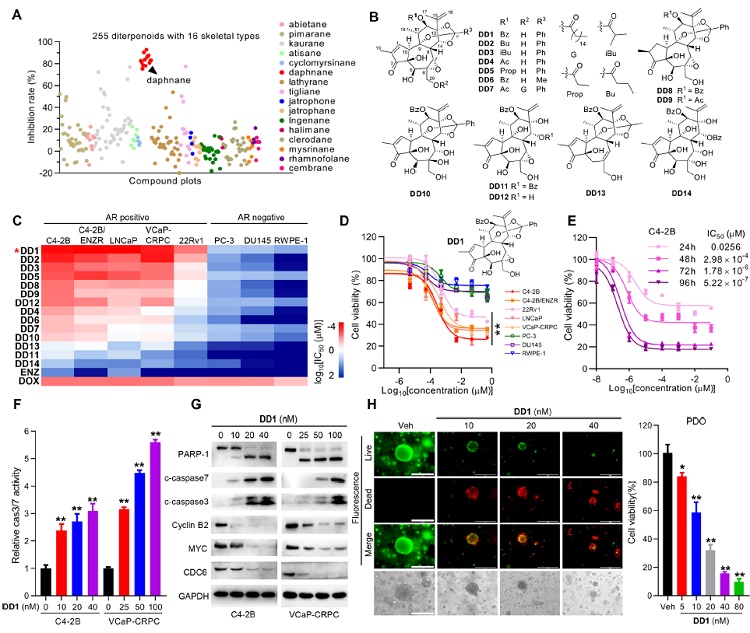
图1. 瑞香烷型二萜显著抑制CRPC细胞增殖和存活。图片来源:J. Am. Chem. Soc.
基于活性分子合成了光亲和探针并在细胞内进行原位靶点垂钓,发现化合物潜在作用靶点为核转运蛋白importin-β1;随后,利用竞争性结合pull-down实验、细胞热转移实验(CETSA)、挽救实验、荧光共定位、表面等离子共振(SPR)等实验进行了证实;片段化蛋白pull-down实验、光交联质谱分析及残基突变实验表明化合物主要作用于importin-β1蛋白C端550aa-876aa区域,其中Gln560、Phe577和Leu580是关键的结合氨基酸。

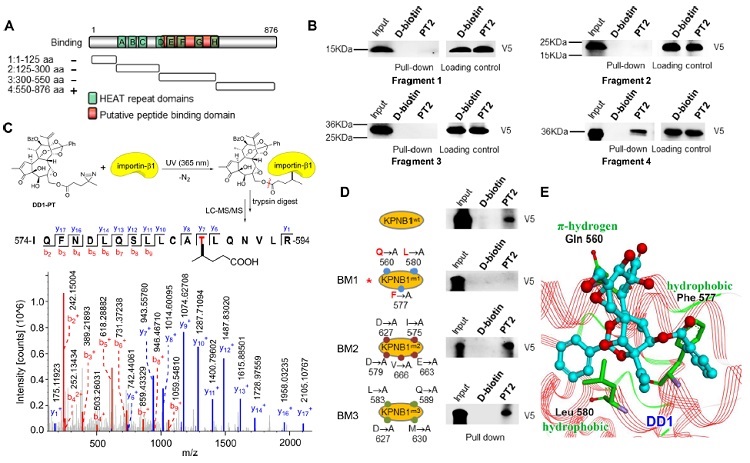
图2. DD1直接靶向核转运蛋白importin-β1。图片来源:J. Am. Chem. Soc.
利用蛋白组学和转录组学技术,发现化合物DD1通过抑制importin-β1影响了多种与CRPC进展密切相关的重要驱动因子(如AR、MYC、E2F1等)的核聚集,阻止了其下游信号网络,进而抑制了CRPC细胞的生长、增殖和存活。研究人员还通过对前列腺癌临床病人数据库调研及免疫组化实验分析,发现相比于正常或癌旁组织,importin-β1在前列腺癌组织中高表达,且与疾病分期、病人Gleason评分和转移程度均呈正相关关系,表明importin-β1与CRPC的发生发展密切相关,扮演着促癌因子的作用。

图3. DD1靶向importin-β1抑制多种CRPC进展相关蛋白核聚集。图片来源:J. Am. Chem. Soc.
最后,研究人员利用22Rv1细胞异种移植瘤和病人来源移植瘤(PDX)模型对DD1的体内抗肿瘤效应进行评价,结果显示化合物在低剂量(0.5 mg/kg)下能发挥强效的抗肿瘤作用,且对各脏器无明显影响。此外,研究人员发现在结合位点突变的异种移植瘤体内模型中,DD1抗肿瘤效果被大大削弱,进一步证实了化合物通过importin-β1发挥抗CRPC功效。
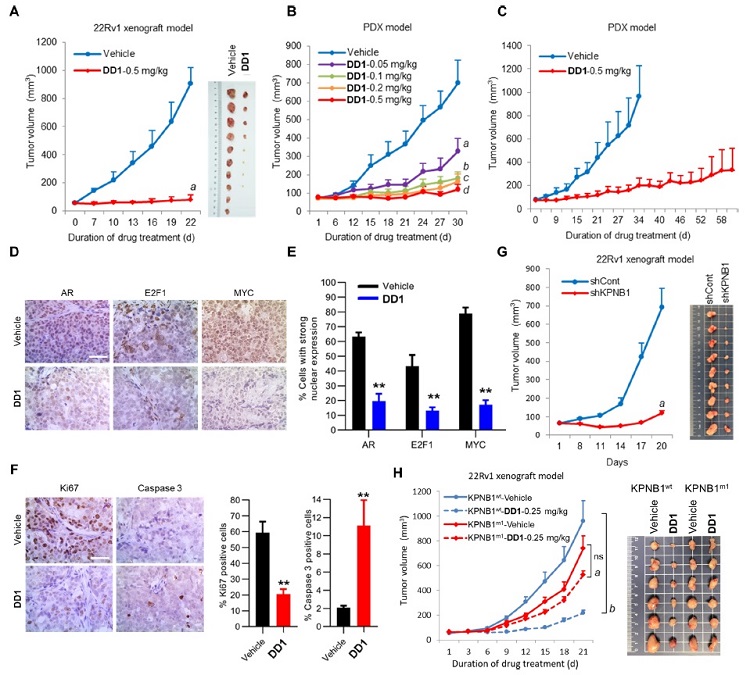
图4. DD1抑制CRPC肿瘤生长。图片来源:J. Am. Chem. Soc.
综上所述,本研究证实了importin-β1作为抗CRPC新靶点的潜力,并为克服CRPC耐药的药物研发提供了天然先导分子。尹胜团队长期致力于大戟科二萜药物开发,已获得了系列结构新颖、活性显著、机制清晰的先导化合物。上述工作不仅阐明了相关药用植物的物质基础,还为治疗相关疾病的药物研发提供了结构多样性的原创先导分子和潜在靶点。
中山大学药学院尹胜团队博士生黄家洛和严雪龙为本论文的第一作者,尹胜教授和王军舰教授为论文的通讯作者。上述研究工作获得国家自然科学基金委面上项目、广东省自然科学基金等多项基金的资助。同时感谢所有合作研究者的指导、支持和帮助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery of Highly Potent Daphnane Diterpenoids Uncovers Importin-β1 as a Druggable Vulnerability in Castration-Resistant Prostate Cancer
Jia-Luo Huang, Xue-Long Yan, Wei Li, Run-Zhu Fan, Shen Li, Jianghe Chen, Zhenhua Zhang, Jun Sang, Lu Gan, Gui-Hua Tang, Hongwu Chen, Junjian Wang*, and Sheng Yin*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c06449
尹胜教授简介

尹胜,中山大学药学院教授博士生导师,国家优秀青年基金、广东省杰出青年基金、广东省“青年拔尖人才”获得者。2003年毕业于复旦大学化学系化学专业,获学士学位,同年保送至中国科学院上海药物研究所硕博连读,师从岳建民院士,专业为天然药物化学。2008年博士毕业,获中科院院长特别奖(获40万启动经费),中科院优秀博士论文提名奖等。2008年10月至2010年6月在澳大利亚Eskitis研究所从事以高通量筛选为导向的海洋天然产物研究,导师为Eskitis研究所Ron. Quinn院士。2010年10月作为中山大学“百人计划”副教授、博导引进,2014年1月晋升为教授。迄今从三十余种高等植物及海洋生物中分离鉴定约500多个化合物,其中200多个为新化合物,新颖碳骨架类型10种,其中3个化合物被天然产物权威评论性杂志 Natural Product Reports 选为热点化合物(Hot off the press),部分化合物具有重要的生物活性,已开发成为先导化合物。在JACS、NPR、JMC、Org. Lett.、Cancer Lett.等杂志上发表通讯作者论文80余篇。研究领域为以活性筛选为导向从天然产物中发现纤维化、抗肿瘤、抗肥胖症活性小分子化合物,并进行结构修饰和相关的药理活性研究。
https://www.x-mol.com/university/faculty/18527

王军舰 博士,中山大学药学院教授、博士生导师,广东省成药性评估及评价工程实验室副主任,广东省杰出青年基金获得者,中山大学“百人计划二期”青年杰出人才。主要从事肿瘤药理学和抗肿瘤创新药物研究工作,致力于发现和确证具有肿瘤治疗价值的药物作用新靶点,研发抗肿瘤创新药物,探索肿瘤耐药性作用机制,为癌症治疗提供新策略。在 Nature Medicine, Nature Communications 等国际专业权威期刊发表研究性论文40余篇。申请专利6项,其中PCT专利3项。获得2016年国际前列腺癌基金会Challenge Award。兼任 Cell Biology International 杂志副主编(Associate Editor)、Nature Review Drug Discovery Chinese Edition编委、《药学学报》及 Acta Pharmaceutica Sinica B 青年编委、广东省药理学会药物筛选与评价专业委员会副主任委员、广东省药理学会抗炎免疫专业委员会副主任委员、中国药理学会表观遗传药理专业委员会委员。
https://www.x-mol.com/university/faculty/65045
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

































 京公网安备 11010802027423号
京公网安备 11010802027423号