JACS:利用C=N双键的极性翻转合成胺类化合物
胺是一类非常重要的结构单元,广泛存在于天然产物、活性药物和功能材料中。发展高效普适的C-N键形成反应成为有机合成化学的重要研究领域。近日,美国杨百翰大学的Daniel H. Ess教授、南京大学化学化工学院的李桂根教授、美国莱斯大学的László Kürti教授等人合作,在J. Am. Chem. Soc. 上发表文章,报道了一种全新普适的方法,用于无过渡金属催化剂参与的合成芳香胺或脂肪胺。该文第一作者Padmanabha Kattamuri博士是南京大学和莱斯大学联合博士后。该方法基于易获得的碳亲核试剂单次或者两次对氮亲电试剂(亲电性的亚胺或者肟)进攻,氮原子的极性翻转通过酮基丙二酸酯的亚胺衍生物或者肟衍生物实现。这种方法操作简便、可大规模制备、环境友好,是传统过渡金属催化的C-N键偶联反应的很好补充。
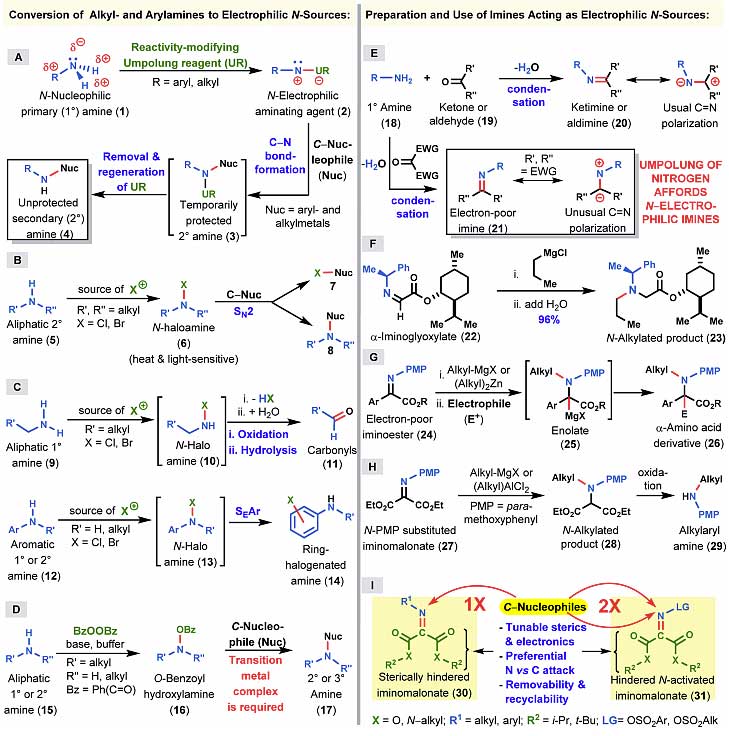
图1. 脂肪胺和芳基胺转化成极性翻转的氮亲电试剂的方法。图片来源:J. Am. Chem. Soc.
图1介绍了将脂肪胺和芳基胺转化成极性翻转的氮亲电试剂的不同方法。如图1A,一级胺和极性翻转的试剂反应形成氮亲电试剂,再和碳亲核试剂反应形成C-N键,最后消除极性翻转试剂得到二级胺。而在图1B中,二级胺则先和亲电卤化试剂反应,极性翻转后,再和碳亲核试剂发生SN2反应,但反应过程中存在7和8两种反应途径,脂肪族一级胺则不适合该反应,消除一分子卤化氢后水解生成醛11。图1C中,芳香一级或者二级胺和亲电卤化试剂反应形成中间体13,再发生芳基亲电取代反应生成新的芳香胺14。图1D中,脂肪族一级或者二级胺先和过氧化苯甲酰反应生成16,再和碳亲核试剂反应生成新的二级或者三级胺17,该反应过程中需要过渡金属催化剂的参与。图1E-1H则是对C=N双键的极性翻转。常规的醛酮和胺缩合形成的亚胺中,碳显正电性,氮显负电性,但当一级胺和带有两个吸电子取代基的酮缩合时,会生成缺电子的亚胺21,这时C=N双键的电子分布与常规情况下有所不同。图1F是Kagan发展的α-亚胺酯22,图1G是N-PMP保护的α-亚胺酯,图1H则是唯一的一例酮基丙二酸酯的亚胺,这些都是极性翻转的氮亲电试剂。基于前人的工作,本文作者设计了如图1I所示的酮基丙二酸酯的亚胺,其中取代基R2的立体和电子效应都可以调控,而通过改变氮的取代基可以选择性地发生一次或者两次碳亲核进攻。

图2. N-取代的亚胺基丙二酸酯及肟亲电试剂的合成。图片来源:J. Am. Chem. Soc.
图2则是对于N-取代的亚胺基丙二酸酯的合成方法。如图2A所示,酮基丙二酸酯与胺在酸性条件下缩合得到亚胺34,34对水和酸都较为敏感,纯化后则得到缩酮胺35,高温时体系发生复杂的分解。而换用图B中的方法,苯基亚硝酸酯36分别和丙二酸二叔丁酯或丙二酸二异丙酯在碱性条件下反应,得到预期的N-取代的亚胺类化合物40和39,产物稳定、易于纯化,且没有缩酮胺生成。通过溶剂筛选,如图2C所示,苯基格氏试剂在DCM/THF的混合溶剂中和亚胺化合物39反应,形成二芳基胺41。如果亚胺40和苯基格氏试剂发生反应,除了生成目标的二芳基胺42以外,还会生成格氏试剂对碳位点进攻的副产物。图E是对肟类亲电试剂的制备方法,从丙二酸二异丙酯出发,先形成亚硝酸酯,互变异构得到肟46,该方法可以实现50克规模的制备。肟46也可以经缩酮化合物44和羟胺反应得到。肟和TsCl反应生成N-OTS的亚胺化合物47,47发生两次苯基格氏试剂进攻得到二胺化合物41。其中,化合物44和47都通过X-射线单晶衍射确定了结构。从44出发还可以制备N-环丙基取代的亚胺48或者间3-甲苯取代的亚胺49用于亲电胺化反应。
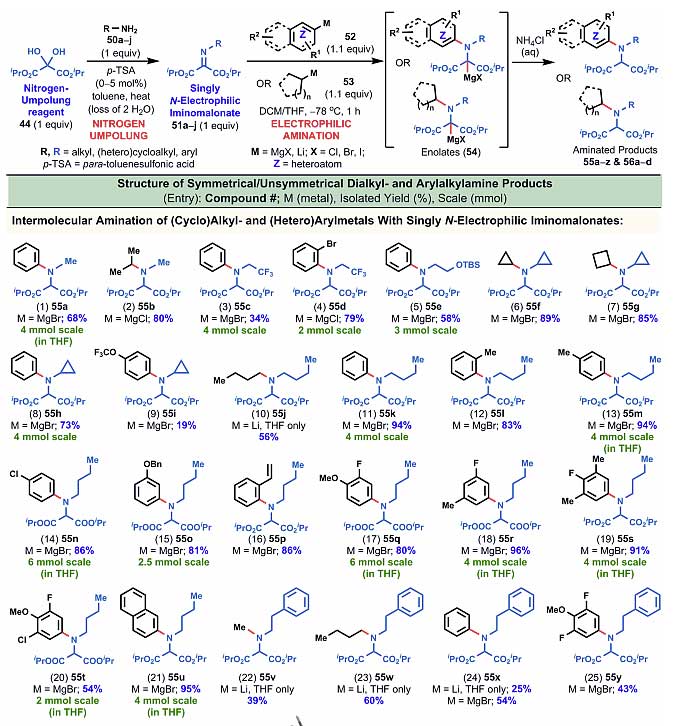
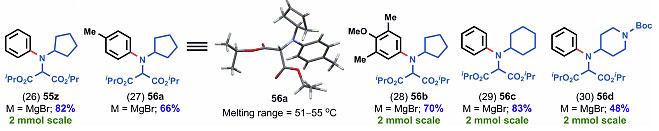
图3. 亚胺类底物的拓展一。图片来源:J. Am. Chem. Soc.
图3是对于底物的扩展,反应从氮极性翻转试剂44出发,和不同一级胺先形成亚胺,再和芳基或者烷基格氏试剂或者锂试剂反应,最终制备得到多种双烷基胺或芳基烷基胺。30个底物都取得了中等到良好的产率,碳亲核试剂中烷基、烷氧基、卤素、三元环、四元环、酯基等都可以很好地兼容,化合物56a还通过X-射线单晶衍射确定了结构。
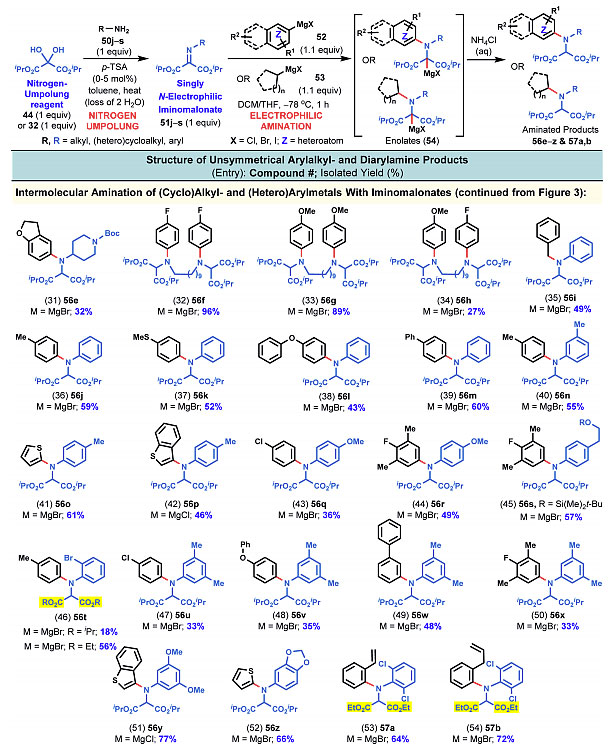
图4. 亚胺类底物的扩展二。图片来源:J. Am. Chem. Soc.
图4依然是从氮极性翻转试剂44出发,44和不同的一级胺先形成亚胺,再和芳基或者烷基的格氏试剂反应,制备各种对称或者非对称的二芳香胺或者芳基烷基胺。在这些例子中,芳香杂环的格氏试剂参与反应也能取得良好的结果。

图5. 肟类氮亲电试剂的底物扩展。图片来源:J. Am. Chem. Soc.
图5则是O-对甲苯磺酰基取代的肟类氮亲电试剂的两次烷基化制备对称二级胺的过程,十几种底物也都取得了中等到良好的产率,烷基、烷氧基、卤素、烯基等都可以兼容。作者还通过理论计算的方法对该反应的过渡态进行了研究,一种是直接的SN2取代反应路径,另一种是格氏试剂对C=N双键加成再发生消除的过程,计算表明,格氏试剂对肟类亲电试剂发生进攻时,对氮位点进攻的能量低于对碳位点进攻的能量。
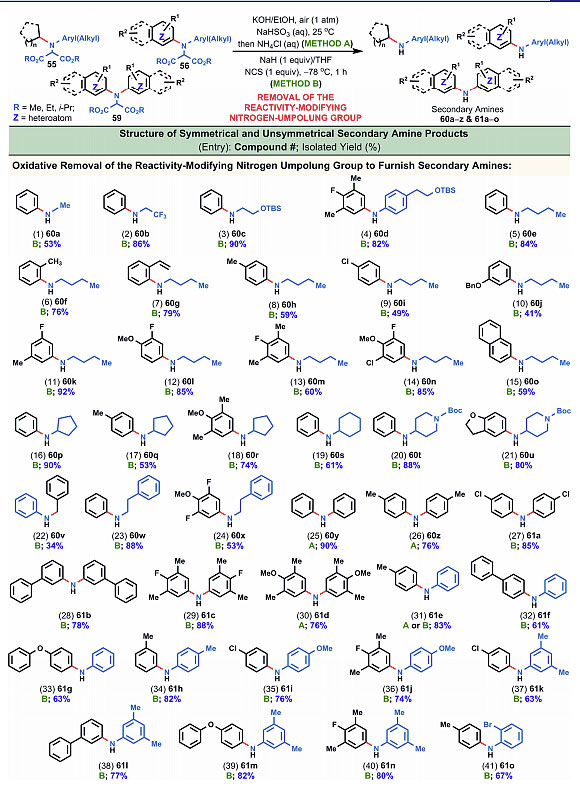
图6. 碱性条件下氧化消除丙二酸酯。图片来源:J. Am. Chem. Soc.
图6是在碱性条件下氧化消除丙二酸酯的实例,40多种底物也都取得了中等到良好的收率,得到了相应的二级胺。
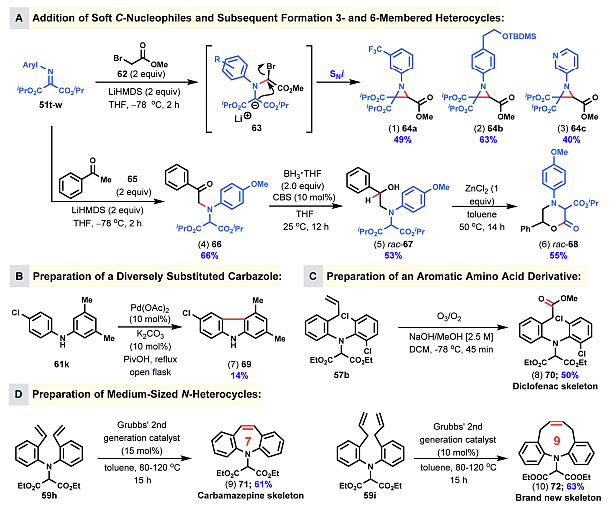
图7. N-亲电胺化试剂的用途及反应产物的衍生化。图片来源:J. Am. Chem. Soc.
图7展示了N-亲电胺化试剂的用途及反应产物的可能衍生化途径。如图7A所示,碱性条件下羰基α位对亚胺的氮亲核进攻,经中间体63可以形成多取代的氮杂三元环64。产物66经硼烷还原得到二级羟基,在Lewis酸的条件下发生内酯化得到氮杂氧杂六元环产物。芳基取代的二级胺61k还可以经钯催化的C-H键活化得到咔唑69,对称的二级胺产物中苯环上带有烯基取代基则可以发生RCM反应分别得到七元环71或者九元环72产物,产率较为理想。化合物57b中的双键可以经臭氧化切断、酯化反应等进行衍生化。可以看出,作者发展的N-亲电胺化试剂以及形成的二级胺都可以进一步衍生化,得到结构多样的合成子。
本文得到了C&EN 的亮点报道[1]。László Kürti教授说,这种思路是他们在查阅文献时偶然想到的,并非第一次利用C=N双键的极性翻转设计反应。但此前得到的亚胺不能用于亲电胺化,因此,László Kürti教授的博士后Padmanabha V. Kattamuri制备了许多不同的亚胺来寻找具有相应亲电活性的亚胺。László Kürti教授实验室可以400克的规模制备亚胺的前体——酮基丙二酸酯化合物,和不同的一级胺缩合就可以大量制备亲电性的亚胺,也可以制备O-对甲苯磺酰基取代的肟类氮亲电试剂。László Kürti教授注意到,该类亲电性的亚胺不仅可以和格氏试剂反应,还可以和烯醇负离子反应,从而可以用来制备吖啶、吗啉以及其他含氮杂环化合物。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Practical Singly and Doubly Electrophilic Aminating Agents: A New, More Sustainable Platform for Carbon–Nitrogen Bond Formation
J. Am. Chem. Soc., 2017, DOI: 10.1021/jacs.7b05279
参考资料:
1. http://cen.acs.org/articles/95/i28/Arylamines-made-easy.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号