皮摩尔级组合化学后期修饰,大环化合物库轻松构筑
药物研发过程中常常会使用高通量筛选(HTS)方法对大量不同的化合物库进行测试,以快速发现哪些化合物能与靶点分子结合。近年来,大环化合物越来越受药物化学家重视,这主要是由于大环化合物能够结合一些具有挑战性的靶点,例如那些传统药物小分子不能结合的“无成药性(undruggable)”靶点。大环化合物类药物有多种,诸如他克莫司、利福平、红霉素、劳拉替尼、格卡瑞韦等。不过,当前常见的大环化合物库仅包含不到11000种化合物,例如:Asinex库(10091种)、ChemBridge库(11000种)。库小了,找到候选药物的机会也就少了。
近日,瑞士洛桑联邦理工学院(EPFL)的Christian Heinis教授(点击查看介绍)课题组发展了一种组合化学方法来构建规模更大、结构更多样化的大环化合物库。具体来说,在纳升体积的皮摩尔级规模下,通过声学液滴喷射技术将化学片段(“n”)以组合化学的方式连接到结构多样化的大环骨架(“m”)的外围胺,生成“m×n”个不同的大环化合物(图1a)。实验操作中,他们将192个大环骨架与104个羧酸片段相结合,生成了一个含有19968个大环化合物的库。酰化反应的高反应效率和少量副产物允许直接进行后续活性测定而无需纯化。在筛选过程中,他们确定了凝血酶纳摩尔级抑制剂(Ki = 44±1 nM)和针对MDM2:p53蛋白质-蛋白质相互作用(PPI)的纳摩尔级抑制剂(Kd MDM2= 43±18 nM)。这一突破成果发表在Nature Communications 上。
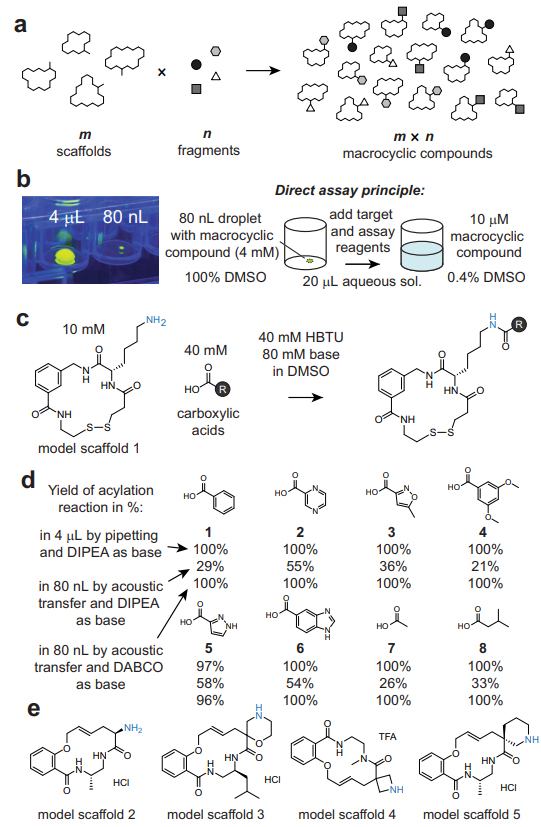
图1. 基于组合化学将片段连接到外围基团来实现大环骨架多样化。图片来源:Nat. Commun.
为了以有效的组合化学方式使大环骨架多样化,作者用羧酸片段修饰了外围胺(图1c)。具体来说,将具有伯胺外围基团(赖氨酸侧链)的模型骨架1与八种结构不同的羧酸1-8在HBTU为活化剂、DIPEA为碱和DMSO为溶剂的条件下进行反应以测试这种酰化作用(图1d),LC-MS分析显示除酸5以外,骨架1与其余酸都能在3 h后完全转化。需要指出的是,选择过量的羧酸是因为较小的羧酸对靶点结合的贡献小于骨架部分,因此不太可能在筛选过程中掩盖大环化合物的活性。为了将合成规模缩小50倍(至800 pmol),作者通过声波转移试剂并将4 μL规模的反应条件应用于80 nL体积的反应,结果显示模型骨架1没有完全酰化(图1d,中),他们推测是由于DIPEA易挥发所致。为此,他们测试了非挥发性碱,当选择DABCO为碱与酸1-8进行反应时,成功地在皮摩尔级规模上实现了对外围伯胺的定量修饰。尽管如此,靠近或位于大环骨架内的伯/仲胺可能会更难修饰。为了评估这些胺的反应性,作者购买了四个具有伯/仲胺的随机大环骨架(2-5;图1e),然后在皮摩尔级规模下与羧酸1-8进行反应,结果显示2、3、5能与所有酸进行定量酰化,4与大部分酸进行酰化,这些结果表明环状仲胺在皮摩尔级规模下也能有效地进行酰化。
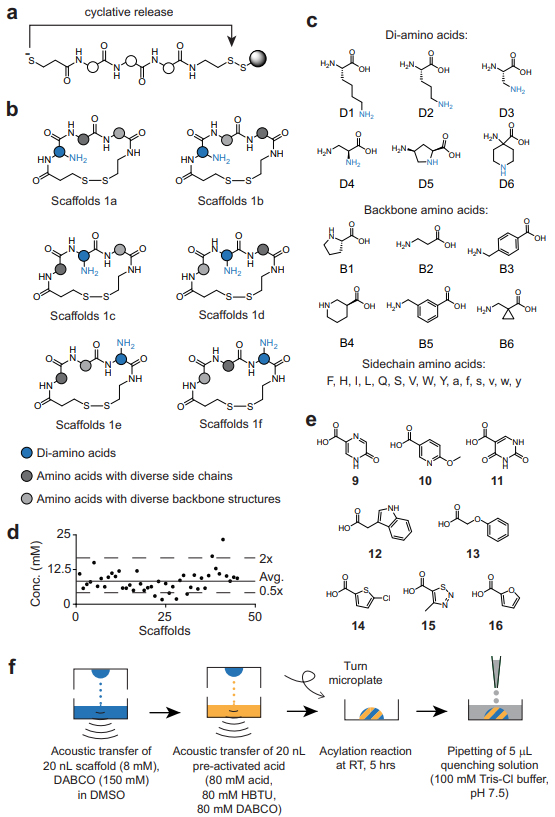
图2. 大环骨架中胺的酰化和库生成。图片来源:Nat. Commun.
随后,作者评估了皮摩尔级合成方案是否适用于大型大环库的构建。为此,作者使用在96孔板中生产小环肽的方法合成了384个随机选择的含有外围胺的环肽骨架。简而言之,通过二硫键在固相上合成短肽、脱除保护基,并通过环化反应释放肽,产生了纯度为90%或更高的二硫环化肽(图2a)。如图2b、2c所示,他们合成了含三种不同氨基酸的骨架(1a-f):1)在侧链具有伯胺;2)带有随机侧链的α-氨基酸;3)具有随机骨架结构。另外,他们定量测定了含有Trp残基(总共45个骨架)的环肽,并以高产率和窄浓度范围获得了大多数分子(图2d)。接着,作者将384个骨架与12种羧酸进行组合反应,得到4608个不同的大环化合物(Library 1,图2e)。为了提高分配速度并减少相对于测试酰化反应的骨架消耗(160 pmol规模),作者略微减少了试剂转移体积,同时还添加了过量的酸(10倍)以确保带有不易接近的胺骨架也能进行定量修饰(图2f)。实际上,每个384孔板的非接触式液体转移需要5分钟,而4608化合物库的合成需要约1小时。
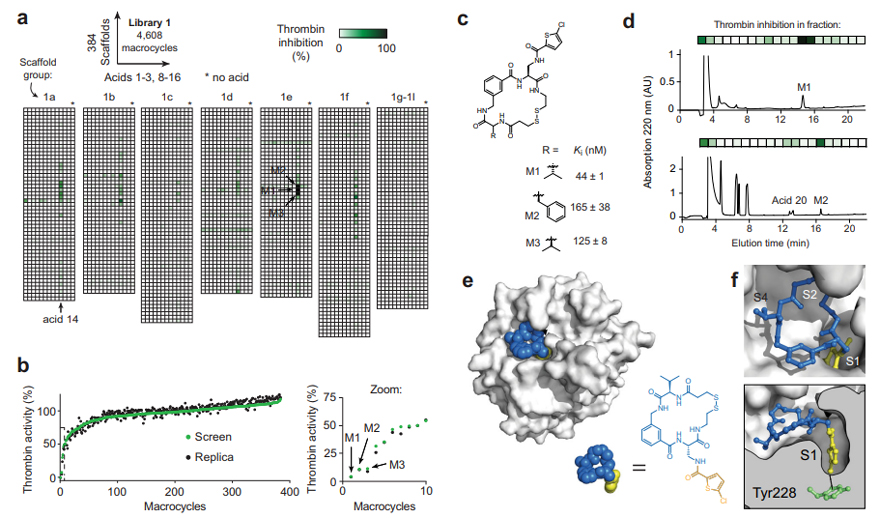
图3. 针对凝血酶筛选大环化合物库、苗头化合物鉴定和结构分析。图片来源:Nat. Commun.
作为概念验证,作者在384孔反应板中筛选了能抑制凝血酶的大环化合物。简而言之,每个孔都含有一个独特的大环化合物(10 μM)、5 μL凝血酶(最终浓度为2 nM)和5 μL荧光底物,以测量残留的凝血酶活性和蛋白酶抑制程度。如图3a所示,作者观察到0.2%(4608个中有9个)的反应中有超过50%的凝血酶抑制作用,并且这些大环化合物都含有氯噻吩羧酸14。随后,作者通过重复氯噻吩羧酸(384骨架×酸14)的大环合成反应和凝血酶筛选来确认结果,观察到相同的结果,证明了皮摩尔级多样化反应和活性筛选的高度重现性(图3b)。值得一提的是,大多数用酸14修饰的骨架不抑制凝血酶,仅有14的对照孔也不抑制,这表明单独的酸片段对凝血酶的亲和力相当弱。事实上,5-氯噻吩-2-甲酰胺(模拟14酰化的二氨基酸“侧链”)仅微弱地抑制凝血酶(Ki = 380 μM),而最好的三个苗头化合物(M1、M2和M3)在结构上都是相似的(图3c),三者的Ki分别为44±1 nM、165±38 nM和125±8 nM,这些结果表明大部分结合亲和力源于环肽骨架的特定结构,同时表明筛选中存在的过量酸可能是惰性的。另外,作者还对与人类凝血酶结合的M1进行了晶体学研究,结果表明M1是一种活性位点抑制剂,其中氯噻吩指向S1特异性口袋并与底部的酪氨酸残基形成芳基氯-π相互作用(图3f),大环骨架则是填充S2(二硫键区域)和S4(缬氨酸)空间(图3e)。需要指出的是,由于本文筛选的骨架中可还原二硫键对于大多数治疗来说是不需要的,因此作者合成了带有不可还原键的替代物并进行了测试,其Ki分别为83±8 nM和135±16 nM,这意味着在不损失太多活性的情况下可以替换二硫键。
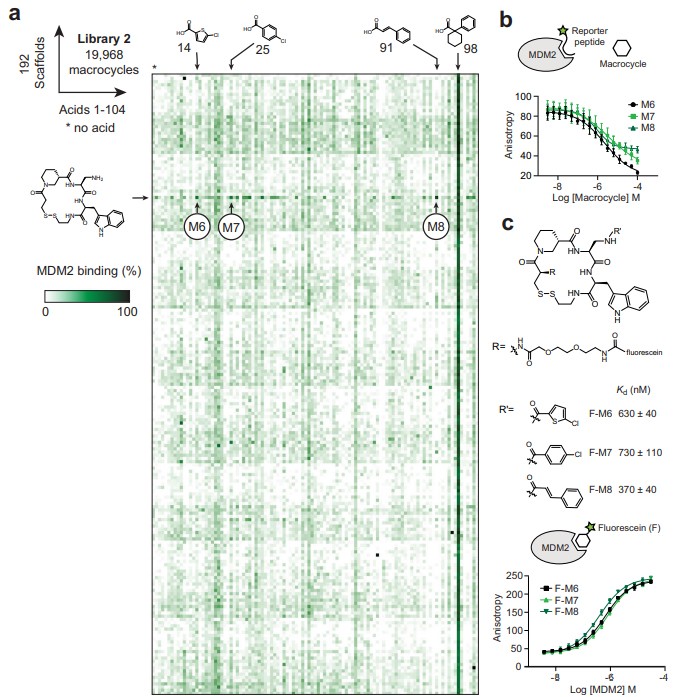
图4. 针对MDM2和苗头化合物特征进行筛选。图片来源:Nat. Commun.
接下来,作者尝试寻找可以抑制经典PPI靶点MDM2:p53的大环化合物。为此,他们合成了192个结构多样化的环肽骨架并将其与104个羧酸片段相结合,生成一个含有19968个大环化合物的库(Library 2)并进行筛选。如图4a所示,他们观察到一组具有较高MDM2结合活性的苗头化合物,它们具有相同的骨架——环[Trp-D3-B4],其中最佳苗头化合物为M6(酸14)、M7(酸25)和M8(酸91),并且纯化的大环化合物M6、M7和M8有效地取代了MDM2中的荧光探针(图4b)。另外,作者还合成了荧光标记的三个大环化合物M6、M7和M8,并通过FP法测量其对MDM2的结合亲和力(图4c),结果显示Kd值分别为630±40 nM(F-M6)、730±110 nM(F-M7)和380±40 nM(F-M8)。
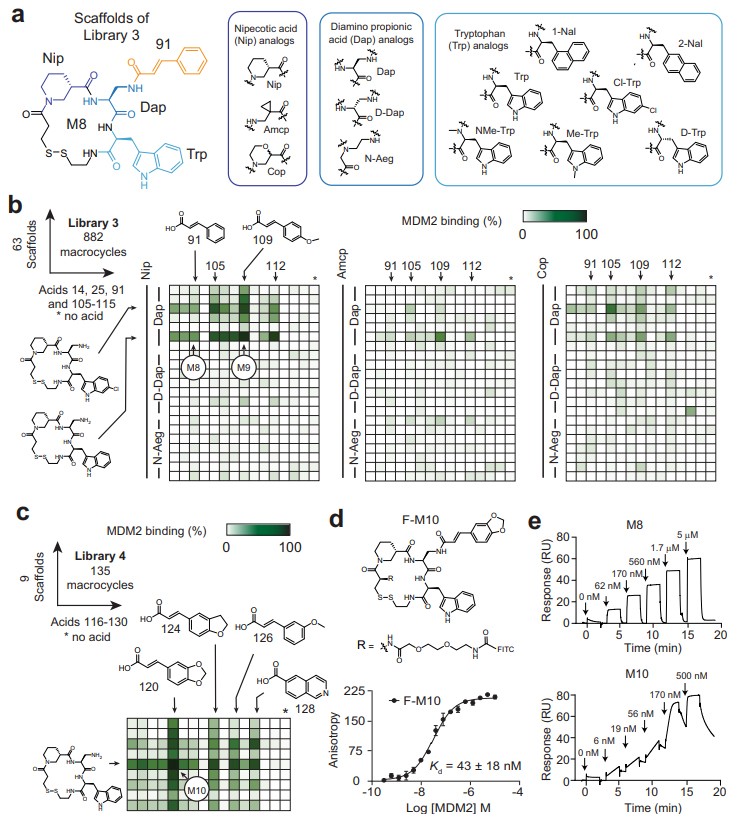
图5. MDM2:p53抑制剂的亲和力优化。图片来源:Nat. Commun.
为了增强在初始筛选中确定的大环M8的效力,作者合成了63个骨架并将其与14种羧酸进行组合得到Library 3(图5a),同时以750 nM的浓度筛选了882个大环化合物(图5b),结果显示M9(酸109)能取代68%的荧光探针,而M8(酸91)则取代21%。随后,作者选择9个最强骨架并将其与15个额外的羧酸进行酰化得到相应的Library 4,发现M10(酸120)能取代84%的荧光探针(图5c)。另外,作者还将大环M10与荧光素结合并使用FP法测量其与MDM2的结合力,结果显示Kd值为43±18 nM(图5d)。最后,通过表面等离子共振(SPR)来测量未标记大环与MDM2的结合力(图5e),结果显示Kd分别为600±300 nM (M6)、550±190 nM(M7)、169±93 nM(M8)和29±14 nM(M10),证实了FP法测定的亲和力范围。
总结
Christian Heinis教授课题组发展了一种组合化学方法,通过声学液滴喷射技术将多种化学片段以组合化学方式连接到结构多样化的大环骨架上。作为概念验证,他们使用羧酸片段与大环骨架的反应,酰化反应的高效率和少量副产物允许直接进行产物活性测试而无需纯化。在筛选过程中,作者确定了分别针对凝血酶和MDM2的纳摩尔级抑制剂。毫无疑问,大环合成和筛选效率的提高以及这种方法的普适性,为药物研发带来了新的可能。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis and direct assay of large macrocycle diversities by combinatorial late-stage modification at picomole scale
Sevan Habeshian, Manuel Leonardo Merz, Gontran Sangouard, Ganesh Kumar Mothukuri, Mischa Schüttel, Zsolt Bognár, Cristina Díaz-Perlas, Jonathan Vesin, Julien Bortoli Chapalay, Gerardo Turcatti, Laura Cendron, Alessandro Angelini, Christian Heinis
Nat. Commun., 2022, 13, 3823, DOI: 10.1038/s41467-022-31428-8
导师介绍
Christian Heinis
https://www.x-mol.com/university/faculty/2737
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





































 京公网安备 11010802027423号
京公网安备 11010802027423号