南开大学邓军课题组JACS:重排三萜spirochensilide A的仿生合成
导读:
近日,南开大学邓军(点击查看介绍)课题组完成了从羊毛甾醇到重排三萜spirochensilide A的仿生合成,该工作发表在J. Am. Chem. Soc.上。
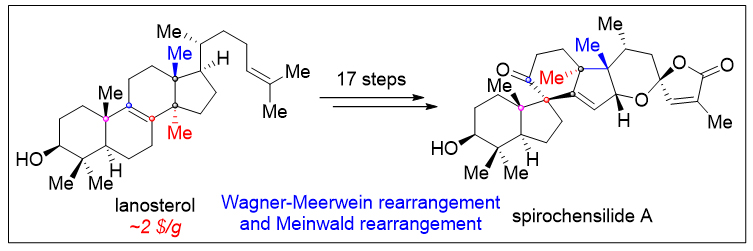
结构丰富多样,生物活性显著的三萜天然产物都是众多传统中药的重要组成成分之一,如羊毛甾烷型三萜天然产物凭借其出色的抗炎镇痛、抗病毒、抗植物病原菌、以及抗肿瘤等活性成为药物化学家关注的重点。Spirochensilides A-B是2015年兰州大学高坤课题组(Org. Lett. 2015, 17, 2760−2763)从秦岭冷杉的枝叶中分离得到了一类结构新颖的羊毛甾烷型三萜天然产物(图1A)。结构上,它们具有螺[4.5]癸烷(B,C环)模块组成的6/5/6/5独特的四环全碳骨架,以及两对相邻的全碳手性中心(C8/C10和C13/C17)。生物活性方面,其对NO的产生有中等抑制作用,可作为炎症研究的潜在探针分子。与此同时,他们还推测Spirochensilide A是由环氧化合物5经Meinwald重排、酶催化的C17C-H氧化及两步Wagner-Meerwein重排反应来得到的(图1B)。其独特的骨架结构和生物活性吸引国内外合成化学家的关注。2020年北京大学的杨震课题组(J. Am. Chem. Soc. 2020, 142, 8116−8121)以半频哪醇重排、钨介导的环丙烯Pauson-Khand反应以及单线态氧促进的氧化环化反应为关键反应以22步,2.2%总收率完成spirochensilide A的首次不对称全合成。

图1. Spirochensilide A 的结构及生源分析
近日南开大学邓军课题组利用生源网络分析方法(Bioinspired Structure Network Analysis)对spirochensilide A开展了生源分析,并提出了spirochensilide A的可能生源合成途径(图1C)。作者认为,羊毛甾醇(4)在一系列酶催化下首先在C17位进行选择性C-H氧化、四取代双键环氧化后,发生两步Wagner-Meerwein甲基迁移重排,形成关键中间体10,接着发生Meinwald重排得到6/5/6/5四环骨架,进一步关上螺缩酮环最终的得到Spirochensilides A。该合成的难点主要在于:如何通过化学手段实现C17位的立体选择性C-H氧化、并调控Wagner-Meerwein双甲基迁移重排以及Meinwald 重排反应的选择性。
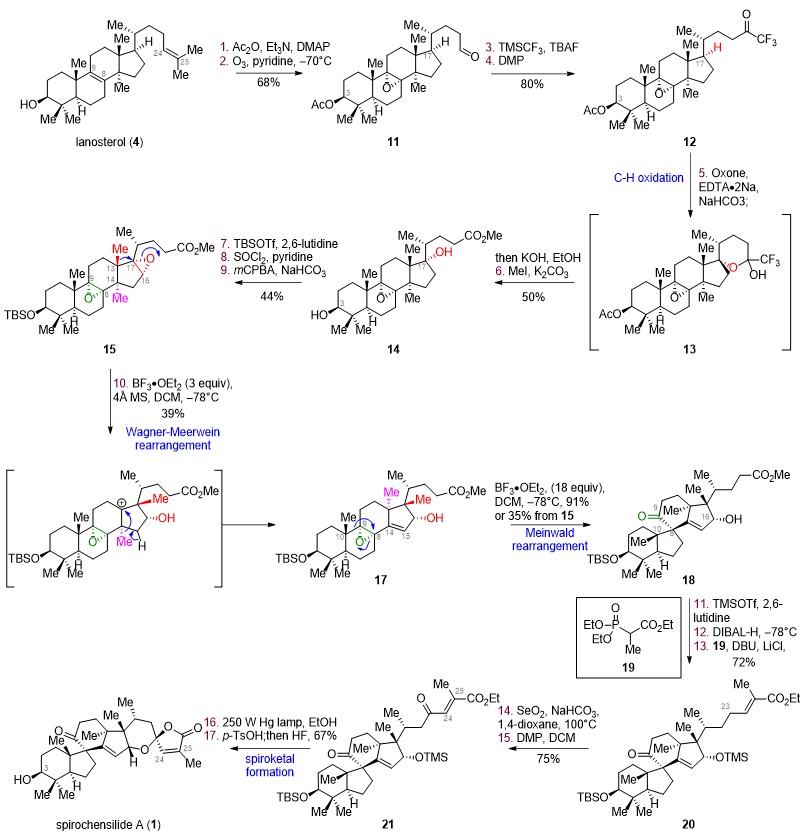
图2. Spirochensilide A 的仿生合成
如图2所示,基于以上的合成设想,作者从商业可得的羊毛甾醇(4)出发,经过乙酰基保护、臭氧化切断侧链、四取代双键环氧化后得到醛中间体11。随后对化合物11侧链的醛进行三氟甲基加成,随后DMP氧化,得三氟甲基酮中间体12。采用杨丹课题组发展的3级C-H氧化方法(J. Am. Chem. Soc. 1998, 120, 6611– 6612.),构建了C17位的氧化态得到半缩醛,并通过KOH水解三氟甲基酮和内酯,得到羧酸,最后将羧酸甲酯化得到中间体14。将14的3-OH用TBS保护基进行保护之后,用SOCl2对C17位的羟基进行消除,将得到的双键用m-CPBA进行环氧化,得到重排中间体15。
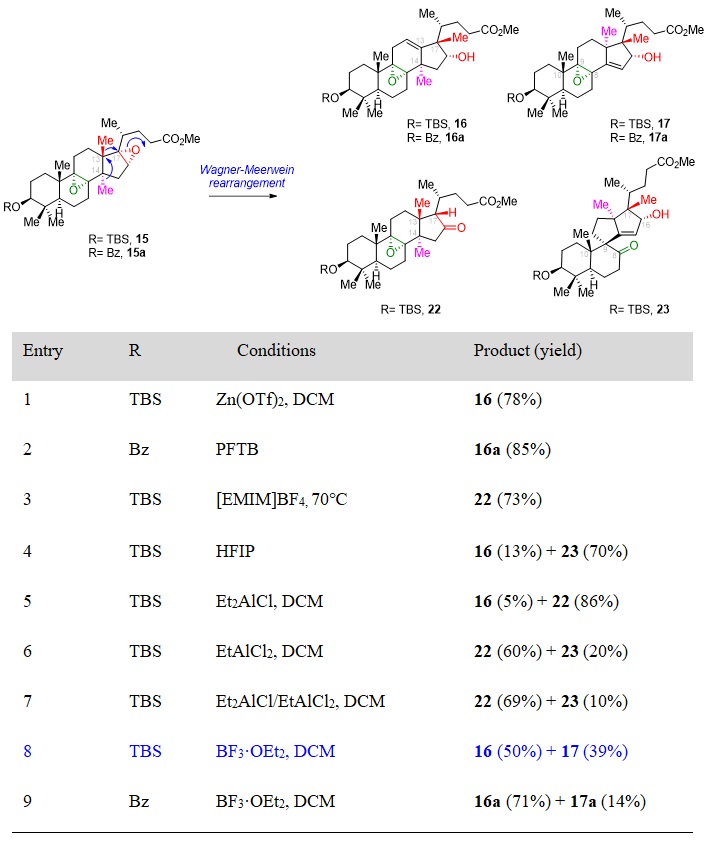
图3. Wagner–Meerwein重排条件优化
得到中间体15之后,经过一系列条件筛选(图3),最终在BF3•OEt2条件下,实现了两步连续的Wagner–Meerwein重排反应得到中间体17,并且在相同条件下继续反应即可得到Meinwald重排产物18,完成了核心四环骨架的构建。在拿到18之后,作者开始构建右侧螺缩酮环系。其认为在侧链碳骨架和氧化态调整到位之后,可以通过一步环化缩合直接构建右侧螺缩酮环系,将18中C16位的羟基用TMS保护基保护,将侧链的酯用DIBAL-H还原至醛,通过HWE反应增碳,得到中间体20。将C23位用SeO2进行烯丙位氧化得到烯丙醇,并用DMP将其氧化为酮,得到中间体21。至此,侧链碳数和氧化态调整完毕,在光照条件下将双键顺反异构化之后,在酸性条件下一步脱出16-OH的TMS保护并完成螺缩酮结构的构建。最后氢氟酸脱出3-OH的TBS保护,得到天然产物spirochensilide A。
综上所述,邓军课题组通过生源分析及理性的合成设计,以选择性C-H氧化及Wagner-Meerwein/Meinwald 重排、光照顺反异构化串联螺缩酮成环等反应为关键步,17步实现了从廉价易得的羊毛甾醇到spirochensilide A的高效仿生转化,为该类天然可能的生物合成途径解析及高效合成提供了线索。相关成果发表在J. Am. Chem. Soc.上,论文第一作者为龙先文博士和李俊博士研究生,邓军研究员为通讯作者,该工作得到了国家自然科学基金及南开大学基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bioinspired Synthesis of Spirochensilide A from Lanosterol
Xianwen Long, Jun Li, Feng Gao, Hai Wu, and Jun Deng*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c07198
通讯作者简介

邓军 研究员
邓军,南开大学化学院及元素有机国家重点实验室特聘研究员,主要从事复杂活性天然产物的合成研究,致力于通过发展新型仿生合成策略来实现复杂活性天然产物的高效合成。2009年在兰州大学化学院获学士学位,2014年在中国科学院上海有机化学研究所获博士学位(导师:李昂研究员),2014年至2016年在美国哈佛大学化学与化学生物学系从事博士后研究(导师:Prof. Andrew Myers)。2017-2020年在中国科学院昆明植物研究所,植物化学与西部植物资源持续利用国家重点实验室开展独立研究工作;2021年全职加入南开大学化学院元素有机化学国家重点实验室,任特聘研究员、博士生导师。先后获得中科院百人计划择优支持,Thieme Chemistry Journals Award,国家优秀青年项目等奖项。近年来,以通讯作者在国际高水平学术期刊Chem,J. Am. Chem. Soc.,Angew. Chem. Int. Ed.等发表多篇学术论文。
课题组提出了基于生源启发的分子网络分析方法(Bioinspired Structure Network Analysis),并将其应用于细胞松弛素家族天然产物的生源分析,建立了该家族通用合成策略,实现了该家族集群式高效合成(Chem. 2021, 7, 212–223; Angew. Chem. Int. Ed. 2021, 60, 15963–15971.)。已完成7类40余个复杂活性天然产物的仿生合成工作,其中35个为首次全合成,(Angew. Chem. Int. Ed. 2018, 57, 14221–14224;Angew. Chem. Int. Ed. 2019, 58, 17552–17557; Org. Lett. 2020, 22, 9421–9426.),课题组主页:http://www.dengjunclub.com/ 。
团队诚招硕士生、博士生、博士后,欢迎有志从事天然产物合成及药物化学研究的同学加盟课题组,共同实现科研梦想和人生梦想!详见团队网站“加入我们”。
https://www.x-mol.com/university/faculty/65891
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

































 京公网安备 11010802027423号
京公网安备 11010802027423号