Nature:接棒Woodward,士的宁生物合成途径全解析
士的宁(strychnine),又名“番木鳖碱”,这种现在常用于毒鼠药的天然产物与有机化学的发展其实缘分不浅。“有机化学”这个名词在1806年被首次提出来之后的十二年,科学家就从马钱子中提取出士的宁。不过,直到130年后,Robinson(1946)和Woodward(1947)才各自独立阐明了士的宁的结构,它是一种复杂的单萜吲哚生物碱。Robinson随后不久曾这样评价士的宁,“就其分子大小而言,它是已知最复杂的物质。”1954年,Woodward等人首次实现了士的宁的全合成(J. Am. Chem. Soc., 1954, 76, 4749-4751),之后Stork等多个课题组开发不同的合成转化策略,先后多次完成了士的宁的全合成。不过有意思的是,自然界中的植物如何合成士的宁,却迟迟未被科学家完全解析清楚。
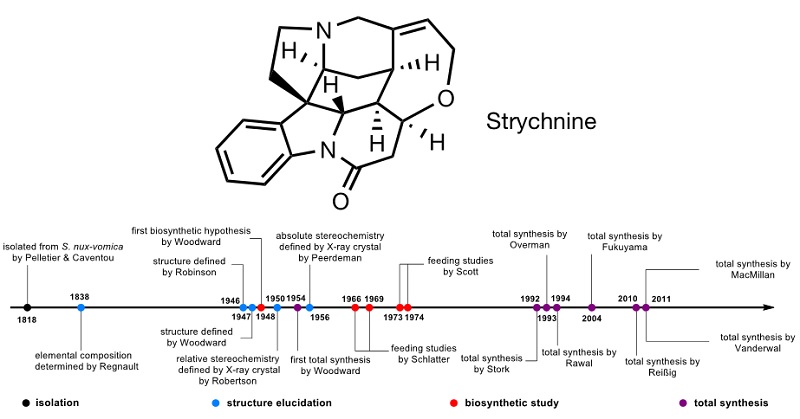
图1. 士的宁结构及其研究的简要时间线。图片来源:Nature
事实上,早在1948年Woodward就提出了士的宁的部分生物合成假说(Nature, 1948, 162, 155-156)。后续的科学家利用放射性同位素标记方法进行研究,发现士的宁的生物合成途径与所有的单萜吲哚生物碱类似,即士的宁(10)的合成前体来源于色氨酸和焦磷酸香叶酯(GPP),随后转化为关键的中间体geissoschizine(1),再经一系列步骤转化为Wieland-Gumlich醛6,接着与乙酸盐结合形成士的宁(10),最后经羟基化和甲基化便能得到马钱子碱(brucine, 15)。然而,有关Wieland-Gumlich醛6与乙酸盐结合和环化的机理目前仍不清楚。虽然前人在士的宁生物合成途径的解析方面有一定的成果,但完整的生物合成途径仍然未知。
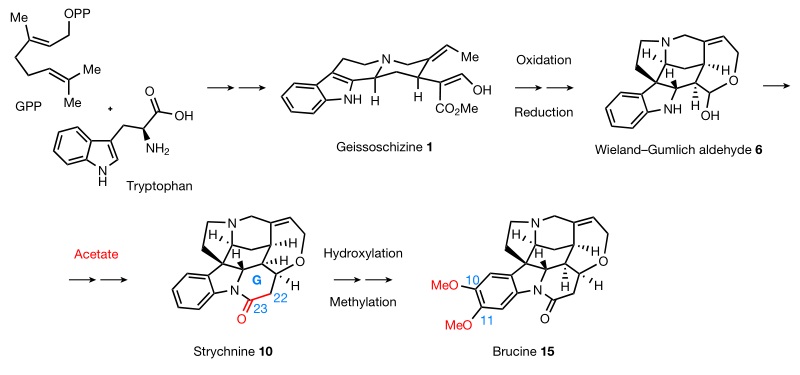
图2. 士的宁和马钱子碱的部分生物合成途径。图片来源:Nature
近日,德国马克斯•普朗克化学生态学研究所的Sarah O’Connor教授课题组使用化学合成逻辑、组学分析和酶学表征的组合,阐明了士的宁、马钱子碱、达波灵碱(diaboline)等多种马钱子生物碱的生物合成途径。该项工作不仅为自然界中士的宁生物合成酶的发现奠定了基础,还为合成生物学提供了新的挑战。相关成果发表于Nature 上。
首先,作者选择马钱子属(Strychnos)的两个成员来研究生物合成途径,即已知能产生士的宁(10)的生产者马钱子(S. nux-vomica)和一个不能产生士的宁的非生产者Strychnos sp.。对S. nux-vomica 的代谢分析表明根部积累了士的宁(10)、异士的宁(isostrychnine, 11)、β-colubrine(13)和马钱子碱(15),而非生产者中并不存在这些生物碱,不过其根和茎中检测到生物合成相关的达波灵碱(8),这也是一种马钱子生物碱。随后,作者进行组织特异性RNA测序以挖掘相关基因,并根据三个标准选择后续步骤的候选基因:(1)在S. nux-vomica 根部高表达;(2)与推定的上游基因共表达;(3)可以编码具有催化功能的蛋白质,其催化功能与作者假设的生物合成途径的化学逻辑相一致(图3)。
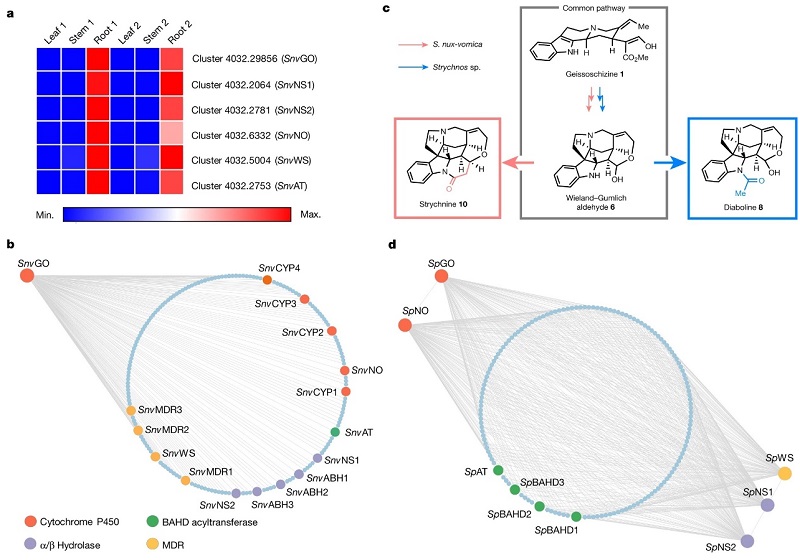
图3. S. nux-vomica 和 Strychnos sp. 中候选基因的表达分析。图片来源:Nature
基于Wieland-Gumlich醛6和生物碱中间体2之间的结构相似性,化学合成逻辑学表明中间体2经酯水解、脱羧、氧化和还原四步就能合成醛6。若此假设是正确的,那么S. nux-vomica 中就应该含有geissoschizine氧化酶CrGO(从长春花Catharanthus roseus 分离而来)的同源物,随后使用CrGO对S. nux-vomica 转录组进行BLAST搜索,确定了转录簇4032.29856(CYP71AY6),后者显示出与上游生物合成基因候选者相似的表达谱(图3a)。另一方面,作者在烟草(Nicotiana benthamiana)叶片中表达该基因并进行geissoschizine(1)浸润,随后叶片提取物的LC-MS分析检测到1被转化为产物2和3(图4b),因此将转录簇4032.29856命名为SnvGO。此外,先前研究表明甲酯的脱羧可通过酯水解引发,因此作者推测α/β水解酶会水解中间体2的酯基并生成norfluorocurarine(4, 图4a)。在SnvGO共表达分析的基础上,作者选择五种 α/β水解酶进行表征(图3b),其中两个候选物(簇4032.2064和4032.2781)可以生成4,同时显著降低了去甲酰化产物3的生成,因此将这两种α/β水解酶分别命名为SnvNS1和SnvNS2。值得一提的是,SnvNS1和SnvNS2在蛋白质水平上具有74%的相似性,并且在烟草表达体系中表现出相同的反应性,因此在后续的实验中均使用SnvNS1。
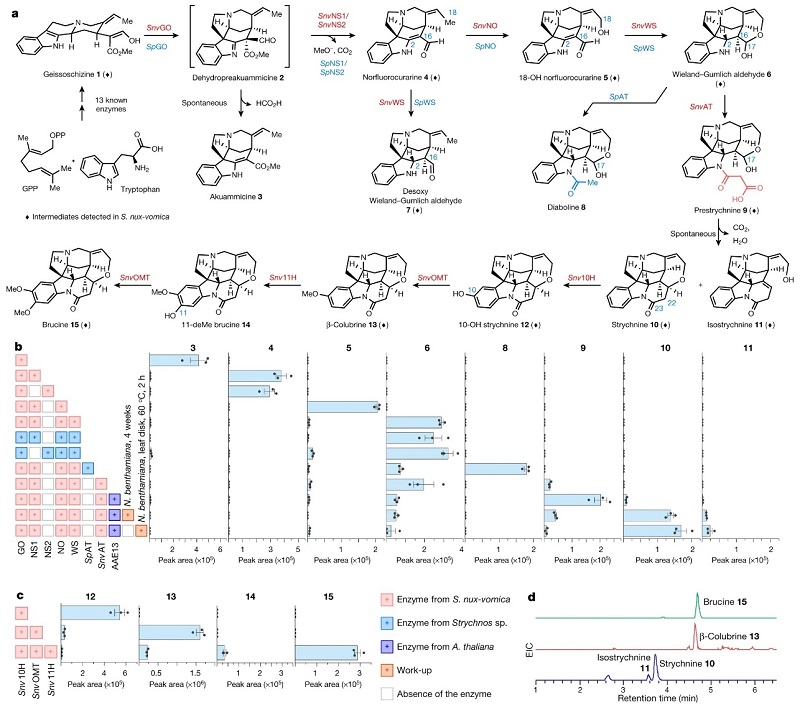
图4. 达波灵碱、士的宁和马钱子碱的生物合成途径研究。图片来源:Nature
如图4a所示,要想将norfluorocurarine(4)转化为Wieland-Gumlich醛6,需要在羟化酶(C18位安装羟基)和还原酶(C2,C16位双键还原)的作用下进行两步转化。为此,作者选择与SnvGO共表达的五种细胞色素P450酶和四种中链脱氢酶/还原酶(MDRs),并在烟草叶片中进行共表达。结果显示细胞色素P450酶(簇4032.6332;CYP71A144)和MDR(簇4032.5004)与SnvGO和SnvNS1结合后能顺利地生成醛6(图4b),为此作者将相应的细胞色素P450酶和MDR分别命名为norfluorocurarine氧化酶(SnvNO)和Wieland–Gumlich醛合酶(SnvWS)。值得一提的是,植物体内和体外的实验表明SnvWS可还原4和5中C2,C16位双键并且对5的催化效率更好,而SnvWS的立体选择性还原主要是由4和5中烯胺部分通过α-面质子化互变异构引发的,然后是β-面的NADPH还原、C18-OH和C16醛之间的自发环化形成半缩醛6。进一步研究发现,SnvWS 中Thr95和Ser309与5 中的C18位羟基形成氢键作用,这就解释了4和5在催化效率上的差异。需要指出的是,4必须先被氧化为5,再被还原为6,若仅有SnvWS则会生成脱氧 Wieland-Gumlich 醛7。
其次,要想从醛6生物合成士的宁(10),必须引入额外的两个碳原子以构建哌啶酮环(即环G,图2)。基于此,作者比较了产生士的宁和不产生士的宁的植物,其代谢分析表明非士的宁生产者Strychnos sp.主要生成达波灵碱(醛6的N-乙酰化产物,图4a),因此作者推测S. nux-vomica和Strychnos sp.中应该含有相同的1→6的生物合成途径(图3c)。事实上,对非生产者转录组同源基因SpGO、SpNS1、SpNS2、SpNO和SpWS进行的BLAST搜索实验表明,在烟草叶片中表达的两种组合均可生物合成6(图4b)。此外,达波灵碱(8)生物合成的唯一剩余步骤是吲哚胺的乙酰化反应,这在生物碱生物合成中通常由BAHD酰基转移酶催化并使用乙酰辅酶A作为酰基供体;而在Strychnos sp.中SpAT负责催化合成8。需要指出的是,S. nux-vomica中含有SpAT的同源酶SnvAT,但是S. nux-vomica却不产生8,这表明8并不是士的宁10的生物合成前体。因此,作者推测SnvAT和SpAT可能具有不同的酶活性。事实上,在烟草叶片中同时表达SnvAT与SnvGO、SnvNS1、SnvNO、SnvWS和geissoschizine 1后仅检测到微量的8,而在叶子提取物中检测到丙二酰化产物,这说明SnvAT是一种具有丙二酰转移酶活性的BAHD酰基转移酶(图4b)。进一步的研究证实了SnvAT负责催化N-丙二酰基Wieland-Gumlich醛9的形成。尽管SnvAT和SpAT的氨基酸序列一致性达到85%,但两者具有不同的催化活性。此外,SnvAT和SpAT的同源模型表明精氨酸残基与丙二酰辅酶A的羧酸盐形成双齿盐桥来实现丙二酰辅酶A的选择性。
另一方面,在烟草叶片的甲醇提取物中(可产生N-丙二酰基Wieland-Gumlich醛9)还检测到微量士的宁(10)和异士的宁(11)(图4b),并且10和11会随时间的推移逐渐积累,而9则会减少。进一步研究发现,9可在体外和生理条件下自发转化为10和11,并且在60 ℃下加热烟草叶片可加速转化(图4b)。基于化学合成逻辑学,作者认为该转化是通过9的β-酮酸部分脱羧形成α,β-不饱和酰胺、C18位羟基oxa-Michael加成(形成10)以及互变异构为β,γ-不饱和酰胺中间体(形成11)进行的。此外,前人通过加热S. nux-vomica 根部的酸提取物可将未表征的中间体prestrychnine转化为士的宁,作者建议将prestrychnine的结构修正为9。
马钱子碱(15)是士的宁(10)的二甲氧基化衍生物,也在S. nux-vomica 根部高度积累。为了鉴定羟化酶,作者选择12种与SnvGO具有较高共表达相关性的全长细胞色素P450酶进行测试,其中Snv10H可以催化生成C10-OH士的宁(12,图4c)。此外,S. nux-vomica 中 β-colubrine(13)的存在表明两个甲氧基是顺序安装的,因此作者鉴定了五种甲基转移酶,其中SnvOMT能够有效地合成13,再在Snv11H和SnvOMT的作用下分别生成14和15。需要指出的是,体外和植物试验表明SnvOMT还可以将C11-OH士的宁(16)甲基化为 α-colubrine(17),同时能将10-deMe brucine(18)转化为15,尽管效率较低。最后,作者在烟草叶片中重构士的宁等生物碱的生物合成途径(图4d),并且该途径涉及的所有中间体都可以在S. nux-vomica 的根部检测到,这表明烟草中的异源重组途径与马钱子植物中的生理相关途径相匹配。
总结
Sarah O’Connor教授使用化学合成逻辑、组学分析和酶学表征的组合,阐明了士的宁等多种马钱子生物碱的生物合成途径。该项工作不仅揭示了植物如何产生这些结构复杂且多样化的生物碱,而且为自然界中士的宁生物合成酶的发现奠定了基础,同时还为合成生物学提供了新的挑战。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Biosynthesis of strychnine
Benke Hong, Dagny Grzech, Lorenzo Caputi, Prashant Sonawane, Carlos E. Rodríguez López, Mohamed Omar Kamileen, Néstor J. Hernández Lozada, Veit Grabe, Sarah E. O’Connor
Nature, 2022, 607, 617-622, DOI: 10.1038/s41586-022-04950-4
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号