表征除草素早期生物合成步骤中的非典型碳位糖基化方式
除草素(herbicidins)是一类从多种链霉菌(Streptomyces)的发酵液中分离出来的腺苷派生抗生素,具有广泛的生物活性,包含对双子叶植物的选择性毒性,抗细菌导致的水稻白叶枯病、抑制人类肠道寄生虫Cryptosporidium parvum 的增殖以及抗藻类与抗真菌的活性。不同的除草素衍生物(3-7)区别在于C2′、C11′与C8′的修饰基团,但其核心共享了罕见的11碳糖形成的三环类结构,亦称金核霉素(aureonuclemycin,2)。此结构被认为是各类除草素衍生物生物合成路经中的中间体。
美国德克萨斯州大学奥斯汀分校(UT Austin)的刘鸿文教授(点击查看介绍)课题组在2017年报道了Streptomyces sp. L-9-10的除草素生物合成基因簇her(图1)。通过13C同位素示踪法,该研究揭示了除草素三环类骨架的吡喃环(ring-C)与呋喃环(ring-A)分别来自葡萄糖与核糖。而连接此两个环所需的碳位糖基化反应则被认为是通过B12 依赖性的自由基 SAM 酶 Her6所催化(图1)。2019年上海有机所唐功利研究员课题组与刘鸿文教授课题组合作确认了金核霉素的生物合成只需四个基因(her4-her7),並阐述从金核霉素出发至各类除草素衍生物的外围修饰路径。本文工作研究了除草素核心结构,亦即金核霉素的生物合成步骤,并发现碳位糖基化方式和先前推测的并不相同。

图1. 除草素生物合成基因簇与推测的生物合成路径
作者通过异源表达her456 分离得到数个除草素相关的代谢产物。核磁表征结果显示,17与18具有11碳糖的结构。然而,17与18并不存在于敲除her4 或her5 基因的突变株发酵液中(图2),作者据此推断Her4和Her5才是催化碳位糖基化的酶。后续的体外实验确认UDP-GA(15)或TDP-GA(16)在Her5的催化下生成23。而NAD+依赖的Her4催化ADP或ATP形成不稳定的α,β-不饱和酮25,其与23上亲核的C1发生迈克尔加成形成新的碳-碳键並被辅酶还原为27。27具有不稳定的二酮结构,无法被直接表征,而其水合过程会引发重排反应生成化合物18(图3)。
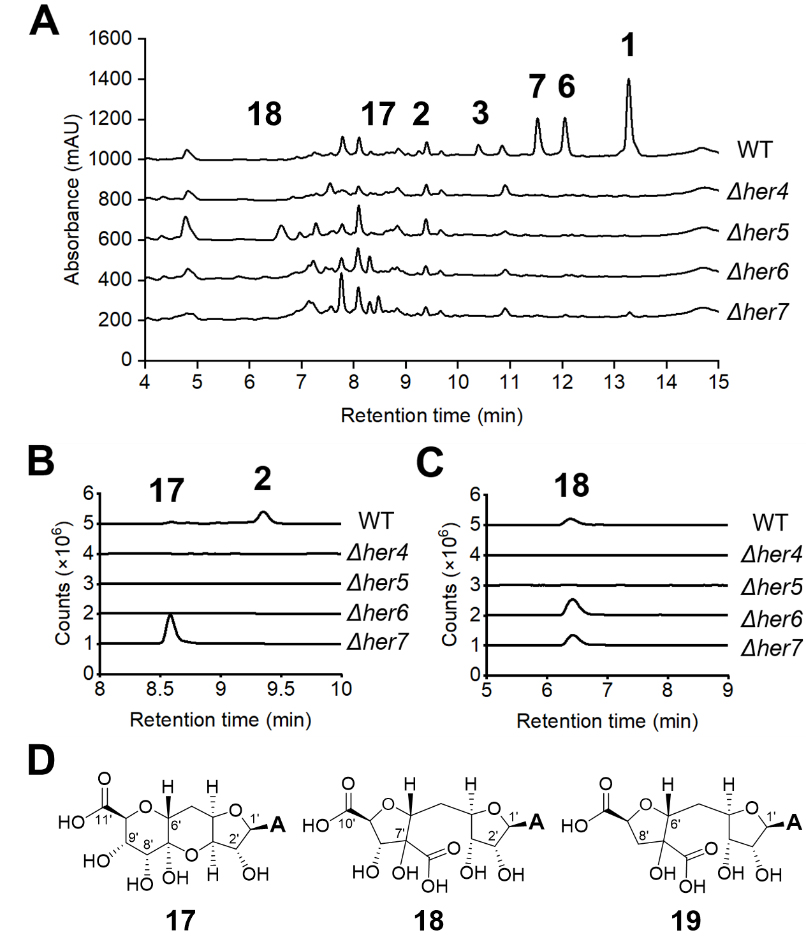
图2. 基因敲除实验与分离得到的化合物结构
虽然Her45的产物22具有S构型的C3’,金核霉素卻具有R构型的C3’,作者因此猜想B12 依赖性的自由基 SAM 酶Her6可催化C3′的立体异构反应,亦即22到33的转化。虽然类似异构反应的催化在此类酶家族中並无先例,但有许多非B12 依赖性的自由基 SAM 酶已知催化这种反应。这一猜想也与在her456 的异源表达株中侦测到C3’为R构型的17相符。最后,由于敲除her7 基因的突变株仍可以生成微量的2,作者推测从33到 2 的还原反应可以由Her7 或是体內固有的还原酶催化。綜合而言,此些发现阐释了由四个基因(her4567)共同参与的金核霉素生物合成。

图3. 推测的金核霉素生物合成路径
这一成果近期发表在Journal of the American Chemical Society 上,美国得克萨斯州大学奥斯汀分校刘鸿文教授课题组的研究生陈章为第一作者,刘鸿文教授为该文的通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Identification of the Early Steps in Herbicidin Biosynthesis Reveals an Atypical Mechanism of C-Glycosylation
Zhang Chen, Shusuke Sato, Yujie Geng, Jiawei Zhang, and Hung-wen Liu*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c05728
导师介绍
刘鸿文
https://www.x-mol.com/university/faculty/361
Liu Lab 主页链接
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号