ACS Nano | 联硒透明质酸纳米抗氧化剂清除ROS缓解结肠炎
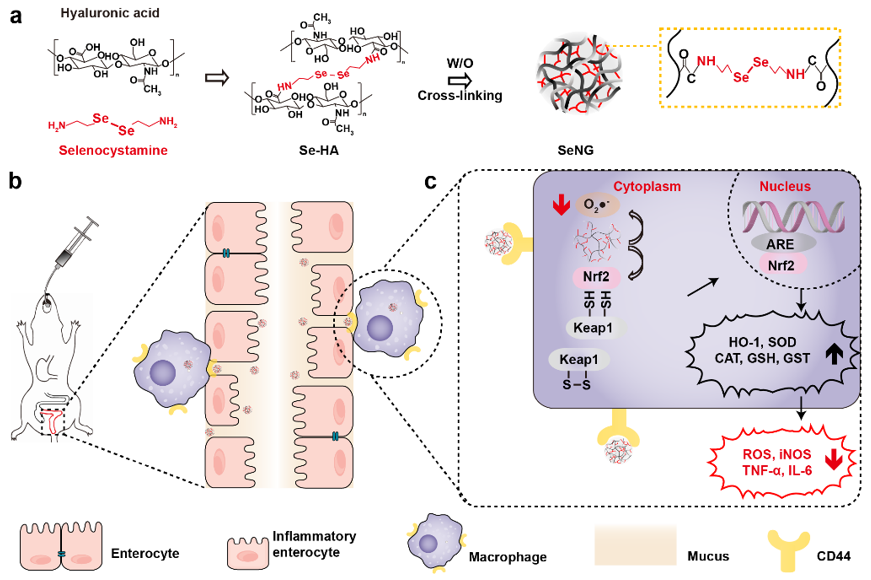
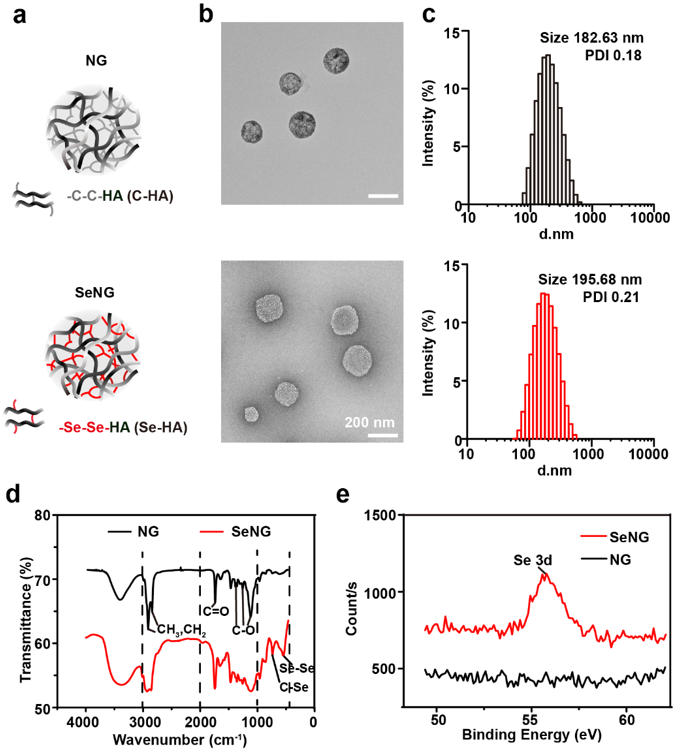
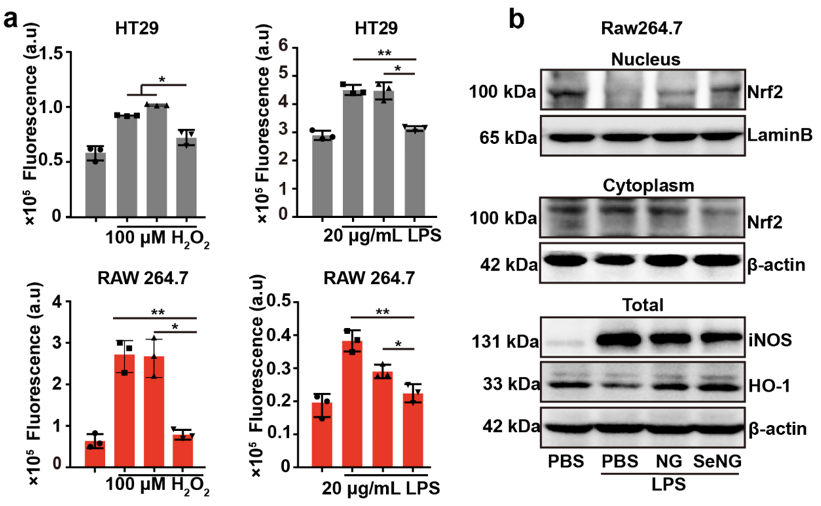
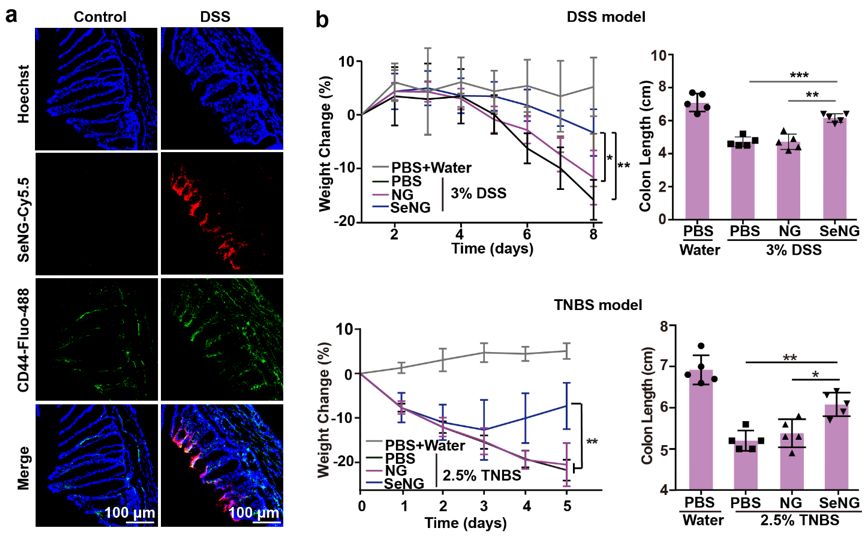
英文原题:Design of Diselenide-Bridged Hyaluronic Acid Nano-antioxidant for Efficient ROS Scavenging to Relieve Colitis 通讯作者: 聂广军,国家纳米科学中心 孟幻,国家纳米科学中心 张银龙,中国科学院大学 作者:Jiaqi Xu (徐嘉琪), Tianjiao Chu (初天娇), Tingting Yu (余婷婷),Naishi Li(李鼐士),Chunling Wang (王春岭),Chen Li(李晨) 背景介绍 活性氧(ROS)的过度产生是炎症性肠病(IBD)的一个重要病理特征,是导致信号转导失调、炎症反应和DNA损伤的直接诱因。ROS过度堆积是IBD病理过程中的核心环节,直接加速病程发展和恶化。因此,清除ROS已成为一种行之有效的IBD治疗策略。但是,正常水平的ROS在维持细胞的信号转导具有重要的生理意义。综合上述双重因素,抗氧化剂用于IBD治疗需要在特定部位的特定细胞内发挥作用,非靶向的抗氧化疗法不仅无效,还会影响其他细胞的生理平衡。 纳米药物作为靶向递送的重要工具,不仅可以克服肠道复杂的环境递送活性成分,还可以通过设计实现对特定细胞的抗氧化特性。其中,联硒键(-Se-Se-)可氧化为硒酸(SeOOH)或还原为硒醇(SeH),而硒醇可继续消耗O2•-经脱水回到联硒键形态,这为联硒键用于IBD的抗氧化治疗提供了有利的理论基础。 文章亮点 近日,国家纳米科学中心聂广军研究员、孟幻研究员和中国科学院大学张银龙副教授在ACS Nano上发表了联硒透明质酸纳米抗氧化剂通过清除ROS以缓解结肠炎的研究工作。团队开发的口服纳米抗氧化剂,通过靶向炎症细胞直接和间接清除ROS,以缓解葡聚糖硫酸钠(DSS)和三硝基苯磺酸诱导(TNBS)的急性结肠炎。 透明质酸(HA)通过硒代胱胺交联组装成纳米水凝胶(SeNG)作为纳米抗氧化剂,SeNG首先通过HA与炎症细胞表面高表达的CD44结合,使其在结肠炎症部位高效率富集,然后作为交联剂的联硒键发挥抗氧化功能,可通过直接清除和上调Nrf2/HO-1信号通路共同降低靶细胞ROS水平,最终实现IBD治疗(图1)。 图1. 纳米抗氧化剂在结肠炎模型中的保护作用示意图。 图2. 联硒透明质酸水凝胶(SeNG)的理化性质表征。 图2 显示SeNG呈现表面粗糙的球形形貌,分散性好,尺寸约为195 nm, FT-IR光谱显示其在760 cm−1和 540 cm−1分别出现 Se-C和Se-Se的伸缩振动吸收峰 ,而 XPS结果也展示了Se-Se在 SeNG中的结合能为 55.2 eV。在 H2O2和LPS诱导胞内ROS实验中,SeNG可以显著清除细胞内 ROS。此外,SeNG可上调Raw细胞核中Nrf2的表达,降低胞质内Nrf2的表达量,同时上调胞内下游信号分子HO-1和细胞整体iNOS表达水平(图3)。作者推测,SeNG纳米抗氧化剂由于联硒键的存在,氧化了胞内KEAP1中含硫醇的片段成二硫键,释放Nrf2导致其在核中积累,从而调控Raw264.7胞内Nrf2/HO-1通路(图1c)。结肠组织切片实验中,作者发现结肠炎模型组结肠上皮cy5.5的荧光信号强度显著增强,且与CD44+细胞呈共定位的现象。在DSS和TNBS诱导的肠炎模型中,经SeNG治疗后,小鼠体重下降和结肠变短均得到了明显的改善(图4)。 图3. 联硒透明质酸水凝胶(SeNG)体外清除ROS调控Nrf2/HO-1信号通路。 图4. 联硒透明质酸水凝胶(SeNG)体内的靶向富集和对结肠炎模型的保护作用。 总结/展望 研究团队突破原有药物抗氧化思路,利用纳米材料本征性质构建具有靶向抗氧化活性的纳米水凝胶,并对其治疗IBD的机制进行了深入研究。此外,研究表明Se元素缺乏在IBD中非常常见,它还参与了T细胞分化和肠道菌群调控,具体反映在结肠局部及全身的硒蛋白浓度降低,但Se的安全窗口较窄,这种靶向递送联硒纳米颗粒至IBD肠道微环境,不仅有效清除ROS,还有望缓释Se元素,改变IBD缺硒的肠道生态。综上所述,该研究工作为联硒纳米抗氧化策略提供了概念证明,为结肠炎治疗提供了新平台。 相关论文发表在ACS Nano上,国家纳米科学中心徐嘉琪博士,硕士研究生初天娇为文章的第一作者, 聂广军研究员,孟幻研究员,张银龙副教授为通讯作者。 通讯作者信息: 聂广军 研究员 聂广军,国家纳米科学中心研究员、中国生物物理学会材料生物学和精准治疗分会的首任会长。长期致力于智能纳米药物用于疾病微环境感应和调控研究,过纳米药物重塑疾病微环境,实现疾病综合治疗,在疾病的血管、基质和免疫调控的智能纳米药物研究方面取得了系列进展。现任纳米科技领域专业期刊Nano Letters副主编及Nano Today编辑。 主页:http://sourcedb.nanoctr.cas.cn//zw/zxrck/200906/t20090602_252681.html 孟幻 研究员 孟幻,国家纳米科学中心研究员,博士生导师。孟幻研究员毕业于北京大学和中国科学院研究生院,获药学专业学士和生物无机化学专业博士学位。毕业后,赴美国加州大学洛杉矶分校(UCLA)从事科研工作,在David Geffen医学院、加州纳米系统研究所(CNSI)、JCCC综合癌症中心(Jonsson Comprehensive Cancer Center)任博士后、助理教授和副教授等职。孟幻研究员长期开展纳米药学、药物递送、纳米生物界面和纳米安全性研究,先后在Nature Communications, PNAS, Science Bulletin, ACS Nano, JACS, Advanced Science, Journal of Clinical Investigation, Accounts of Chemical Research, Advanced Materials, Biomaterials 等学术期刊发表SCI论文100余篇,引用约1.7万次, h因子54,曾被科睿唯安(Clarivate)认定为全球高引科学家(交叉科学类)。以课题负责人身份,承担国内外研究课题十余项,长期担任几十种学术期刊的审稿人、国内外基金评审人,并拥有多项专利,并进入转化阶段。 主页: 张银龙 副教授 张银龙,中国科学院大学纳米科学与技术学院、副教授、博士生导师。2018年6月在吉林大学获医学博士学位。2018年7月年至2021年7月获得“博新计划”的支持,国家纳米科学中心做特别研究助理。2021年7月加入中国科学院大学纳米科学与技术学院,2022年入选中科院青促会会员。先后在Nature Biotechnology, Nature Biomedical Engineering, Nature Protocols, Advanced Materials 等发表多篇高水平研究论文。课题组围绕临床疾病治疗面临的实际科学问题,借助纳米药物的特殊性能,服务临床需求。 主页: 出版信息: ACS Nano 2022, ASAP Publication Date: July 21, 2022 https://doi.org/10.1021/acsnano.2c05558 Copyright © 2022 American Chemical Society




如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号