金坚团队/王刚团队合作报道首例靶向NSD2的PROTAC分子
NSD2是组蛋白赖氨酸甲基转移酶,属于核受体结合SET域蛋白(Nuclear Receptor Binding SET Domain)家族的一员,该家族还包含了NSD1和NSD3。NSD2可以催化Histone H3 lysine 36(H3K36)的单甲基化和双甲基化反应。据报道,在多发性骨髓瘤(multiple myeloma,MM)中,经常可以检测到NSD2的过表达。除此之外,NSD2还在多种癌症中存在异常表达、突变。
除了一个保守的催化结构域,NSD2还有多个蛋白-蛋白相互作用的结构域(例如PHD结构域和PWWP结构域)。越来越多的研究显示,这些蛋白-蛋白相互作用结构域对于NSD2发挥蛋白功能至关重要,但是其具体的机理还有待进一步探究。鉴于该蛋白在癌症与生物学中的意义,有越来越多的研究人员致力于开发靶向NSD2蛋白的小分子。
蛋白质水解靶向嵌合体(PROTAC)技术如今正受到药物研发领域的极大关注。西奈山伊坎医学院金坚(Dr. Jian Jin)教授课题组长期致力于开发新型PROTAC技术。近日,金坚教授团队和北卡罗莱纳大学教堂山分校王刚(Dr. G. Greg Wang)团队合作在Journal of Medicinal Chemistry 杂志上发表研究论文,利用前人报道的选择性靶向NSD2-PWWP1结构域的探针分子,将其通过合适的链与E3连接酶的配体连接,得到了首例能够选择性降解NSD2的PROTAC分子MS159。此外,MS159还可以降解造血转录因子IKZF1/3,对GSPT1不起作用。
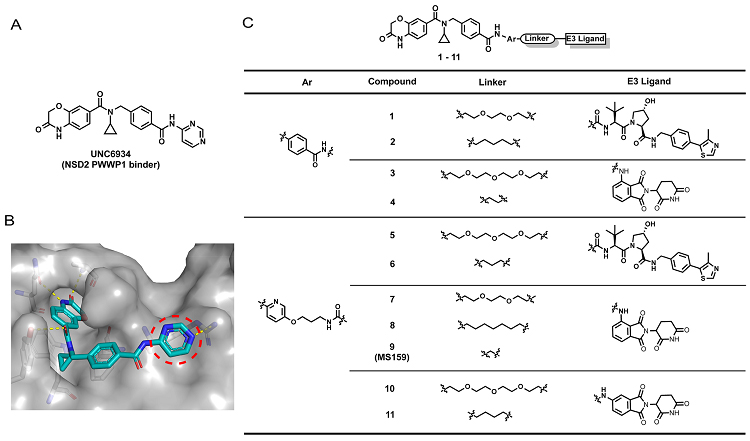
图1. 本项研究中构建的靶向NSD2的PROTAC分子
探针UNC6934是近期报道的能够选择性靶向NSD2-PWWP1结构域,并能进一步通过扰乱蛋白-蛋白相互作用阻止赖氨酸甲基化的小分子化合物。其和NSD2的共晶显示,UNC6934的苯并恶嗪酮结构伸向结合口袋内部,并与相邻的氨基酸残基形成关键的氢键作用;环丙基伸向一个正好可以将其紧紧容纳的疏水口袋;末端的嘧啶则延伸至溶剂区域。基于这一共晶结构以及其他课题组的研究成果,作者设计并合成了一系列可能的PROTAC分子。感兴趣的读者可以在论文中找到这些分子的具体合成方法。
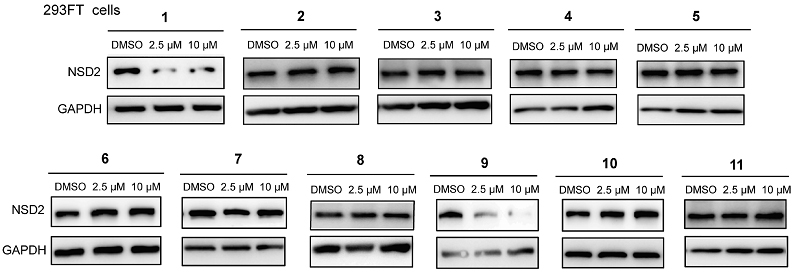
图2. 对化合物1-11降解NSD2的能力进行考察
作者对这些分子在293FT细胞系中降解NSD2的能力进行考察,其结果如图2所示,化合物9(MS159)展现出了最好的NSD2降解能力。因此,选取了化合物9作为接下来研究和衍生化的重点。
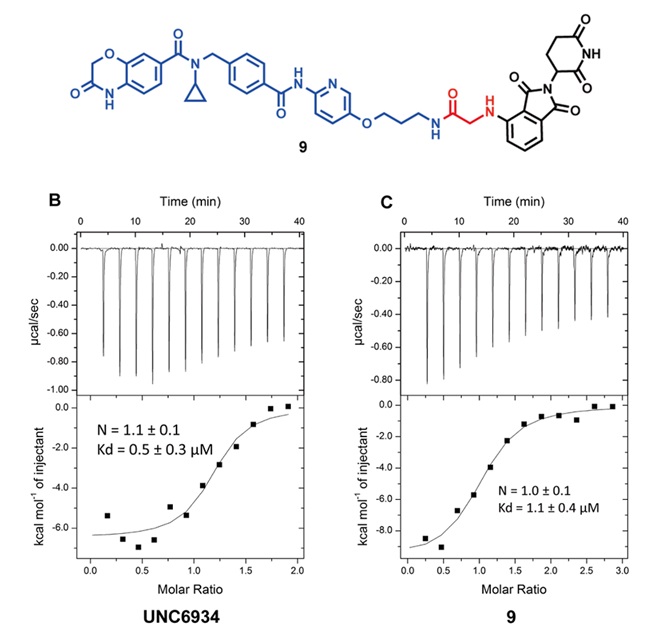
图3. 化合物9及其ITC数据
化合物9的结构如图3所示。在本项研究中,通过ITC(isothermal titration calorimetry)实验来考察9和NSD2-PWWP1结构域的结合能力,并与探针分子UNC6934进行对比。从图中数据可以看到,9的Kd为1.1±0.4 μM,和UNC6934的Kd(0.5±0.3 μM)接近。这一结果,证实了对于连接位点选择的合理性。
接下来,继续在293FT细胞系中对化合物9进行了更详细完整的表征,结果如图4所示。9对NSD2的降解是剂量依赖的,48 h时即可观察到明显的降解,72 h时达到最大降解,Dmax > 82%, DC50 = 5.2±0.9 μM。对降解现象的机理进行研究,作者发现MG132(蛋白酶体抑制剂)、MLN4923(Nedd8激活酶的小分子抑制剂)、泊马度胺以及UNC6934都可以显著抑制9对NSD2的降解。这一结果说明,9介导的NSD2的降解依赖NSD2、CRBN和泛素-蛋白酶降解系统。作者还通过洗脱实验验证了9对NSD2的降解是可逆的。此外,体外酶活实验(涉及20个甲基转移酶)显示,在10 μM时,化合物9对甲基转移酶的活性没有明显影响;药代动力学实验显示,以50 mpk的剂量,通过IP途径给药时,9在小鼠体内有较好的生物利用度,8 h后,血浆中9的浓度仍然可以维持在相对可观的水平(0.98±0.04 μM)。
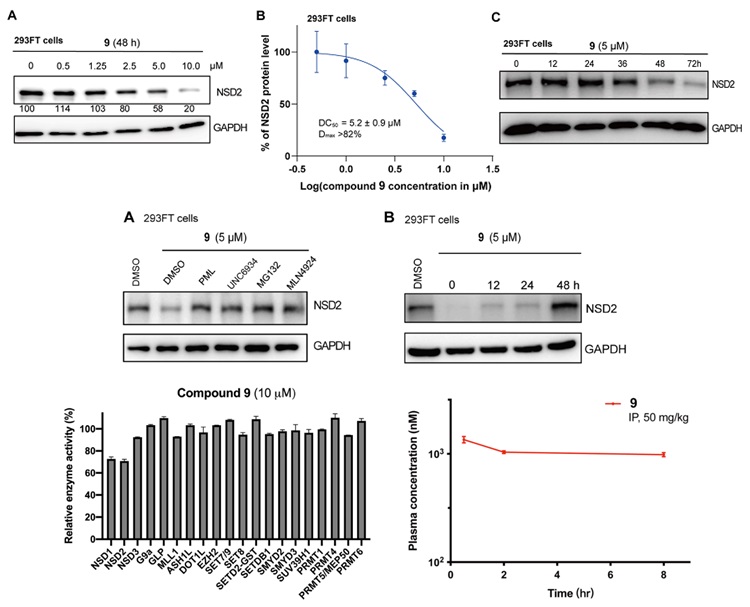
图4. 对化合物9(MS159)的研究
为了更好地对化合物9进行研究,作者还合成了两个阴性参照化合物,结构如图5所示。在化合物9的E3连接酶配体的二甲酰亚胺处引入甲基,得到了化合物17(MS159N1),17不能招募CRBN但是仍然可以和NSD2-PWWP1结构域结合;将9的环丙基改为异丙基获得化合物18(MS159N2),18可以招募CRBN但是不能结合NSD2-PWWP1。
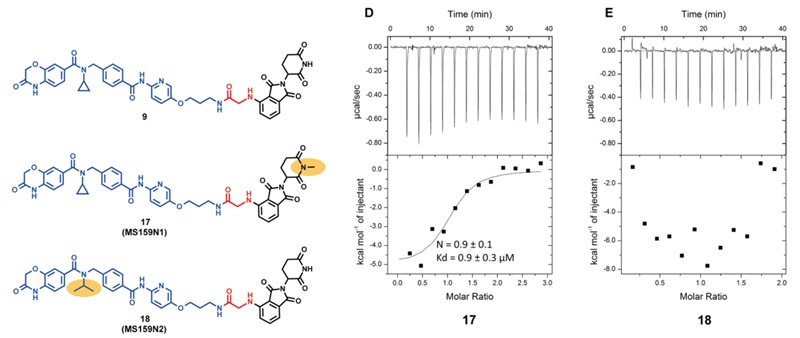
图5. MS159对应的阴性参照物17/18及其ITC数据
接下来如图6所示,作者考察了化合物9/17/18和UNC6934在多发性骨髓瘤细胞KMS11和H929中的效果。Western Blot结果显示,17/18/UNC6934对细胞中NSD2水平没有影响,而9仍然表现了明显降解NSD2的能力。此外,作者还通过一系列实验发现,除了降解NSD2以外,9和18可以显著降解造血转录因子IKZF1,轻微降解IKZF3,对GSPT1不起作用,且这些降解作用是依赖于泛素-蛋白酶体系发生的。最后,细胞增殖实验的结果显示,9表现出最好的抑制细胞增殖的活性,17次之,18和UNC6934未能明显抑制细胞增殖。这一结果证明,9对肿瘤细胞的抑制活性来自其对NSD2和IKZF1/3的降解,且前者对活性的贡献更多。
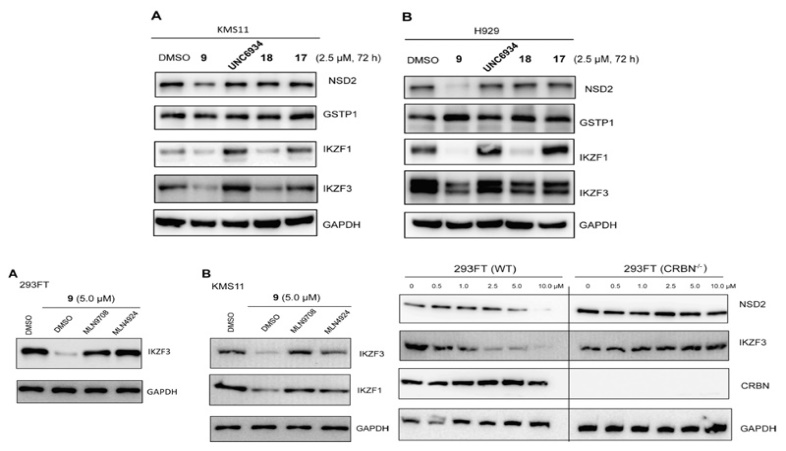
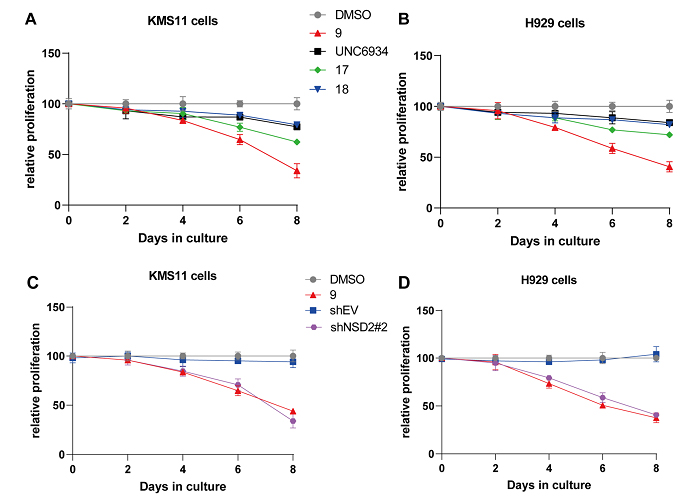
图6. 化合物9/17/18/UNC6934在多发性骨髓瘤细胞中的表现
综上所述,作者报道了首例靶向NSD2的PROTAC分子MS159。该分子能够选择性降低细胞中NSD2以及IKZF1/3的水平,并表现出较好的对多发性骨髓瘤细胞的抑制活性。该份工作近期发表于Journal of Medicinal Chemistry 上,共同第一作者为孟繁烨博士和许晨曦博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery of a First-in-Class Degrader for Nuclear Receptor Binding SET Domain Protein 2 (NSD2) and Ikaros/Aiolos
Fanye Meng, Chenxi Xu, Kwang-Su Park, H. Ümit Kaniskan*, Gang Greg Wang*, and Jian Jin*
J. Med. Chem., 2022, DOI: 10.1021/acs.jmedchem.2c00807
金坚教授简介

金坚,著名药物化学家, 美国西奈山医学院冠名教授,西奈山医疗发展中心主任, 西奈山伊坎医学院药理学系、肿瘤和神经科学系、帝势癌症研究所终身教授。本科毕业于中国科学技术大学;博士毕业于宾夕法尼亚州立大学,师从著名有机化学家Steven M. Weinreb。
金坚教授具有二十多年的小分子药物研发经验,在国际药物化学界享有盛誉。曾任葛兰素史克(GlaxoSmithKline)公司药物化学部门总监、北卡罗来纳大学教堂山分校药物化学部副主任等职。金坚教授课题组的研究方向主要为:(1)组蛋白甲基转移酶选择性抑制剂的发现;(2)G蛋白偶联受体偏向性配体的开发;(3)靶向肿瘤蛋白新型降解剂的研制。迄今为止已在相关领域发表超200篇SCI论文,包括Nature, Science, Cell, Nat. Med., Nat. Rev. Drug Discov., Nat. Biotechnology, Nat. Chem. Biol., Nat. Reviews Cancer, Cancer Cell, Nat. Cancer, J. Am. Chem. Soc., Angew. Chem. Int. Ed., Sci. Adv., Nat. Commun., J. Med. Chem.等;申请美国及国际专利70余项。
金坚
https://www.x-mol.com/university/faculty/311500
课题组主页
https://labs.icahn.mssm.edu/jinlab/
王刚教授简介

王刚,北卡罗莱纳大学教堂山分校生物化学与生物物理系、药理学系和莱恩伯格综合癌症中心教授,博士生导师,课题组主要从事基因调控和染色质生物学、相分离调节以及干细胞和癌症的研究,取得诸多原创性发现,代表性成果发表在Wang J et al. Nature Cell Biology (2022);Yu X, et al. Science Translational Medicine (2021);Ahn JH, et al. Nature (2021);Fan H, et al. Nature Genetics (2020);Zhang Z, et al. Nature (2018);Cai L, et al. Mol. Cell (2018);Lu R et al. Cancer Cell (2016);Cai L, et al. Mol. Cell (2013)。
现根据工作需要,长期招聘博士后研究人员,热忱欢迎志趣相投的青年朋友加入。
关于王刚教授实验室科研方面的更多情况,请访问网站:http://www.gregwanglab.com
https://www.x-mol.com/university/faculty/347389
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号