JACS:利用Ser/Thr ligation策略化学合成PD-1蛋白
细胞程序死亡受体-1(PD-1)是一个表达在活化的T 细胞上的糖蛋白,其在调控T细胞活性中扮演着至关重要的角色,被称为免疫检查点(Immune Checkpoint)。在人体中,PD-1 通过与其配PD-L1 结合降低T细胞的活性,从而避免T细胞过度活化杀伤正常细胞,实现免疫自身耐受。然而,这一通路可被癌细胞劫持,癌细胞通过高表达PD-L1与PD-1结合,欺骗免疫T细胞,实现免疫逃逸,导致癌症的发生(图1)。基于上述的机制,阻止癌细胞的PD-L1与T细胞的PD-1相互作用,可使T细胞保持活性,杀死癌细胞。

图1. 免疫逃逸与免疫疗法的机制
当前,一系列PD-1单克隆抗体阻断剂,包括Keytruda可瑞达、Opdivo欧狄沃、卡瑞利珠单抗、特瑞普利单抗、替雷利珠单抗和信迪利单抗,被开发并应用在不同类型的癌症治疗中,极大地提高了癌症患者的生存率。然而,并不是所有的癌症病人都对上述的免疫疗法有响应,只有15-30%病人能从PD-1阻断疗法中获益。因此,提高PD-1疗法的响应率意味着提升这一疗法在临床癌症治疗中的应用范围,造福更多患者。
近日,香港大学化学系的李学臣教授(点击查看介绍)团队,通过Ligation Embedding Aggregation Disruptor (LEAD) 策略(图2),首次实现了PD-1蛋白的化学全合成,有望通过化学手段,揭示PD-1糖基化在PD-1与PD-L1相互作用中的功能,从而阐明PD-1疗法低响应率的机制,为寻找新型高效的PD-1阻断剂打下基础。

图2. LEAD 策略在PD-1 合成中的应用
PD-1作为一个免疫检查点蛋白受体,长期以来备受关注。然而,其化学全合成一直未有报道,究其原因是这一蛋白的部分序列存在难以合成和纯化的难题。在本研究中,研究人员发现将该课题组发明的丝氨酸/苏氨酸/半胱氨酸残基多肽连接术(STC Ligation)应用在容易发生聚集沉淀的多肽序列中时,可以极大地改善难溶多肽的溶解度。进一步研究表明,STC Ligation的中间体能够破坏难溶多肽的二级结构,改变多肽的构象,促进多肽溶解(图3)。
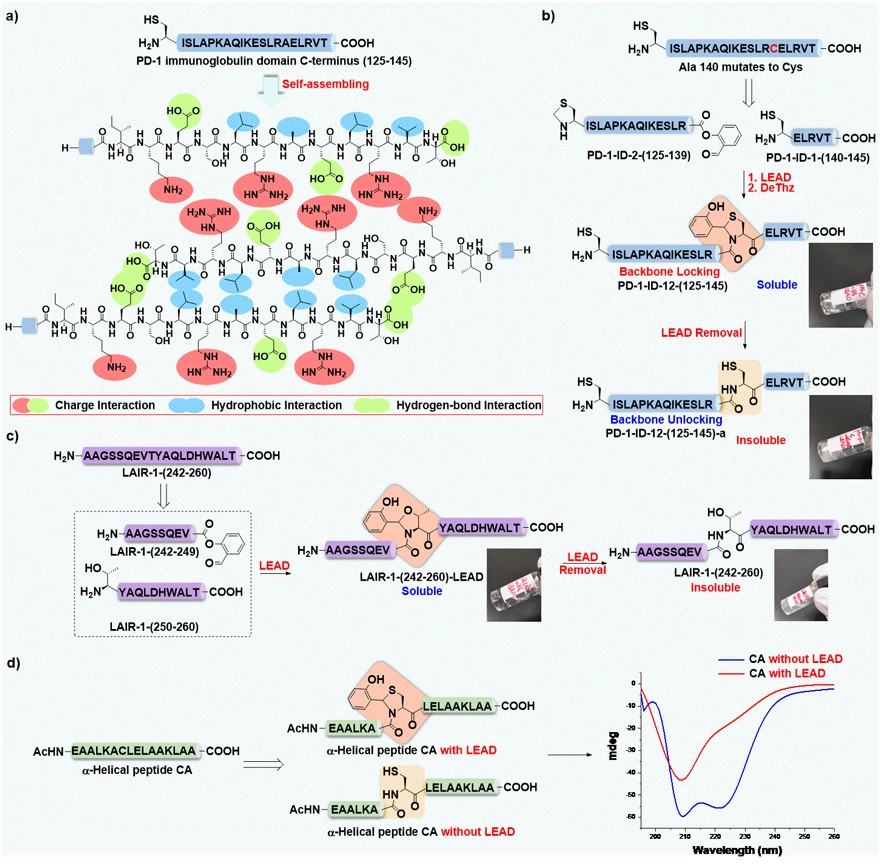
图3. LEAD策略对多肽溶解性和构象的改变
基于这一发现,研究人员将这一策略应用在PD-1的难溶序列中,发现这一策略不仅能够改造多肽溶解性,使其易于纯化,而且能够提高多肽片段之间的连接效率,促进蛋白化学合成。在此基础上,研究人员将这一策略与O-acyl isopeptide 联用,提出了多肽骨架扰动接力策略,解决了PD-1合成中N端片段极度难溶的问题。
总而言之,该工作开发了Ligation Embedding Aggregation Disruptor (LEAD)策略,实现了PD-1蛋白的首次化学合成,相关结果近日发表在J. Am. Chem. Soc. 上。文章的第一作者为香港大学博士后吴鸿翔,通讯作者为香港大学化学系李学臣教授(李学臣教授课题组现招聘博士后,欢迎有志于大分子化学合成、药物化学或化学生物学的科研项目及相关研究背景的同学联系)。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ligation Embedding Aggregation Disruptor Strategy Enables the Chemical Synthesis of PD-1 Immunoglobulin and Extracellular Domains
Hongxiang Wu, Tongyao Wei, Wai Lok Ngai, Haiyan Zhou, and Xuechen Li*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c05350
导师介绍
李学臣
https://www.x-mol.com/university/faculty/244129
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号