NHC-Ni(II)催化环丙烯与异腈的[5+1]芳胺化反应
作为最小的环状烯烃,环丙烯具有极高的反应活性,是有机合成中一类非常重要的合成砌块。在过渡金属的催化下,环丙烯可以作为二碳合成子或三碳合成子与烯烃、炔烃及其它不饱和键发生[2+3]、[3+2]、[3+4]等多种环加成反应,是制备环状小分子化合物的理想原料。然而,环丙烯与CO/异腈的[5+1]环化反应相对较少,这主要是因为底物反应性的不匹配,常常受到高Homo反应性(例如异腈聚合、芳基取代的环丙烯自身重排生成稳定的茚类化合物)和其它开环反应性(线性亚氨基合成)的影响。
基于Dotz苯环化反应机理,Semmelhack/Wulff小组于1994年首次报道了芳基取代环丙烯与CO的[5+1]环化反应路线(图1a)。他们利用Cr/W/Mo羰基络合物,高效制备了各式各样的1,4-hydroquinones类化合物(Semmelhack/Wulff 1,4-hydroquinones synthesis)。然而,此类反应通常需要使用化学计量的金属试剂及过量的CO气体,应用范围受到了较大限制。因此,发展催化的环丙烯参与的[5+1]环化反应具有重要意义。
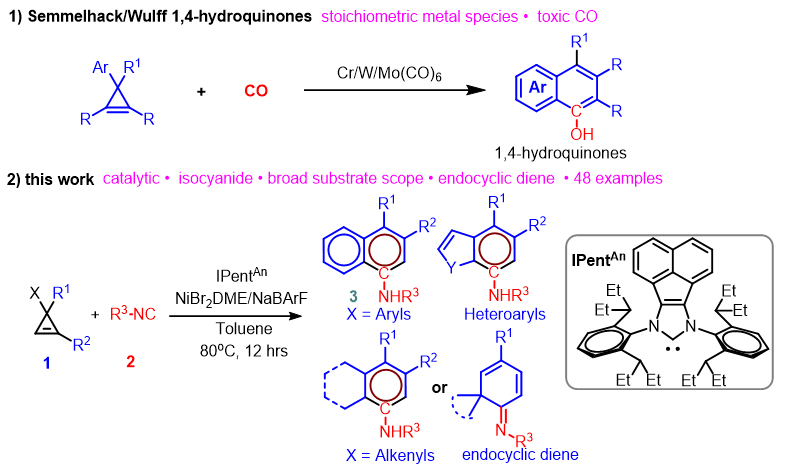
图1. [5+1]芳环化
近年来,南方科技大学何振宇(点击查看介绍)课题组一直从事NHC-Ni(II) 催化张力烯烃的选择性转化研究。他们通过NHC的位阻效应抑制张力烯烃自身的不利聚合,将张力烯烃有效转化为环戊二烯等目标化合物(Angew. Chem. Int. Ed., 2020, 59, 5288; Angew. Chem. Int. Ed., 2019, 58, 5702)。最近他们以异腈代替CO,报道了NHC-Ni(II) 催化下环丙烯与异腈的[5+1]芳胺化反应,为多种类型的芳胺(特别是大位阻二芳胺)及环已二烯亚胺的制备提供了一条新路径(图1b)。他们以NiBr2DME/IPentAn/NaBArF为催化剂,在80 ℃条件下,芳基取代环丙烯与非活化异腈在甲苯溶剂中反应12小时,以优秀的收率及选择性得到(杂)芳胺产物。该反应体系适用于多种类型的环丙烯及异腈,如二取代环丙烯、三取代环丙烯、杂环取代环丙烯、芳基异腈及烷基异腈(图2)。此外该反应可以兼容多种官能团,如末端双键、醚、卤素、酯、腈等。使用烯基取代环丙烯为底物时,可以得到特定的多烷基取代苯胺,这为合成在药物上具有重要应用价值的苯胺化合物提供了有益的补充。此外,该反应体系还可以制备大位阻的二芳胺类化合物,如2,6-二叔丁基取代芳胺(3wh),此类化合物目前还未见通过钯催化的Buchwald-Hartwig偶联制备的报道。
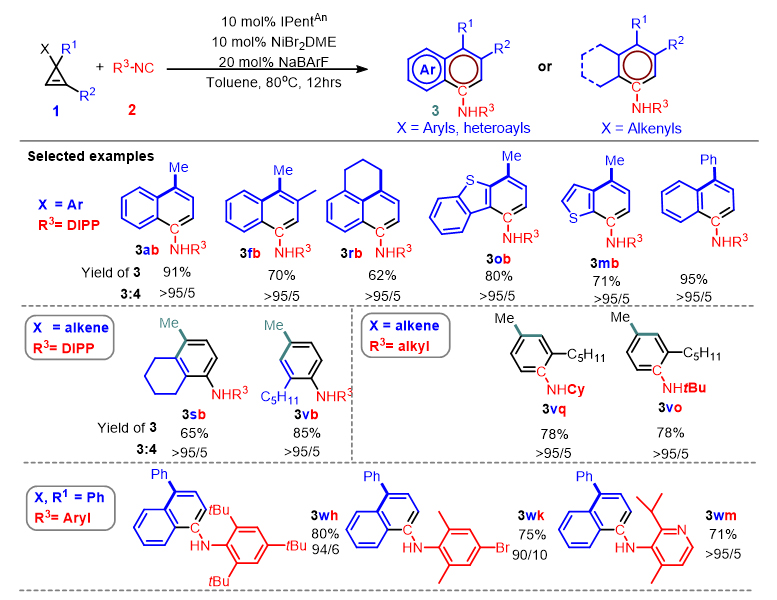
图2. NHC-Ni(II) 催化下环丙烯与异腈的[5+1]芳胺化反应
尽管完整的反应机理还有待研究,作者认为NHC的使用抑制了底物的Homo反应性,在异腈插入和重排后,反应最后一步经历了一个芳基化过程(图3)。作者针对性设计了四个ß,ß-二取代乙烯基环丙烯底物用于该反应体系,果然发现由于没有可供转移的H原子,产物停留在了芳基化之前的阶段,以良好到优秀的收率制备了二取代环已二烯亚胺类化合物。此外,作者还对反应产物进行了衍生化操作,并发现了一个颇有意思的溶剂控制的区域选择性溴化反应。以NBS为溴化试剂,当乙腈为溶剂时,溴化反应专一性的在胺基邻位发生;当DMF为溶剂时,溴化反应专一性的在胺基对位发生,这为产物的进一步官能团化提供了可能。
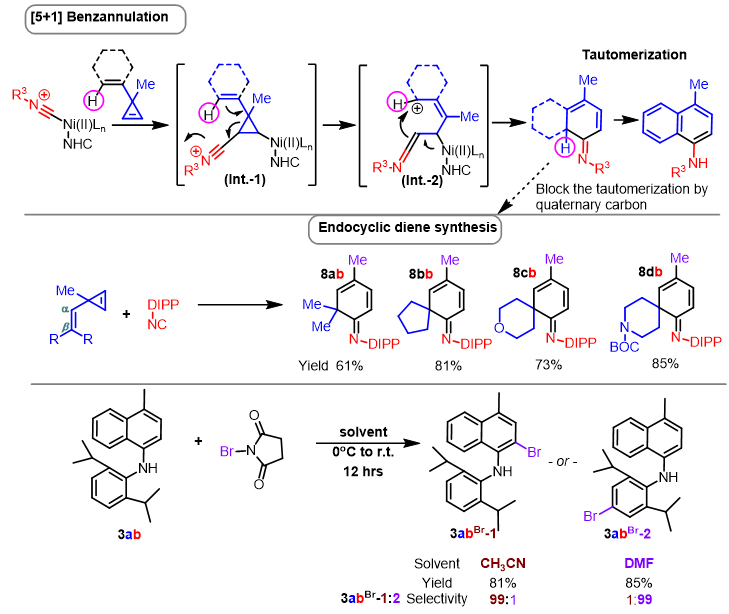
图3. 可能的机理、催化内环二烯合成以及溶剂控制的区域选择性溴化反应
以上研究结果近期发表于Nature Communications,南方科技大学研究副教授黄建强为论文第一作者兼共同通讯作者,南方科技大学副教授何振宇为项目指导导师及通讯作者,该研究工作得到了国家自然科学基金、广东省催化化学重点实验室、广东省基础与应用基础研究基金等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

NHC-Ni(II)-catalyzed cyclopropene-isocyanide [5 + 1] benzannulation
Jian-Qiang Huang, Meng Yu, Xuefeng Yong & Chun-Yu Ho
Nat. Commun., 2022, 13, 4145, DOI: 10.1038/s41467-022-31896-y
导师介绍
何振宇
https://www.x-mol.com/university/faculty/45853
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号