有Ni才行:Science报道合成复杂胺的通用策略
近一个世纪以来,胺类化合物的商业生产不断增加,并且年产可超过600万吨。随着全球的需求量不断增加,预计未来十年全球胺市场将以每年8%的速度增长。现如今,胺类化合物已广泛应用于制造高附加值化学品、药物分子、农用化学品和聚合物等领域,大多数农用化学品和市场上最畅销药物的前200种中有超过75%都是胺类化合物。化学家已经开发出多种方法来合成胺类化合物,例如腈和硝基芳烃的催化加氢、羰基化合物的还原胺化、醇的胺化、胺取代卤代化合物、烯烃的加氢胺化等,其中腈的催化加氢是合成苄胺和脂肪族伯胺最具原子经济性且成本最低的工业方法,同时在尼龙(原料:1,6-己二胺)、高性能塑料(原料:1,4-丁二胺)、表面活性剂(原料:烷基二甲胺)、乳化剂(如氨基乙基哌嗪)和生物活性分子的大宗工业生产中发挥着关键作用。然而,通过交叉偶联策略来合成仲胺和叔胺(包括腈类交叉偶联合成N-甲胺)却存在挑战性和选择性问题。如图1所示,腈与胺的交叉偶联可构建五种不同胺以及各种杂环:即腈1加氢生成伯亚胺2,后者可被还原为伯胺3,伯胺3可与中间体亚胺2生成仲亚胺,随后加氢获得仲胺5(自偶联途径)。按照类似的反应途径还可构建叔胺6,而其它不同的伯胺7或者仲胺8均可与2形成亚胺9或10,然后加氢得到仲胺11和叔胺12(交叉偶联途径),并且仲胺11可继续与2反应产生叔胺13。值得注意的是,亚胺2还可以与芳香腈反应构建各种杂环,特别是2,4,5-三取代的咪唑 14。然而,伯亚胺2的氢化速率要比相应的仲亚胺慢,这严重阻碍了腈与胺还原交叉偶联的应用与发展。
近日,德国莱布尼茨催化研究所的Matthias Beller教授和Rajenahally V. Jagadeesh教授等人使用均相镍催化体系(Ni- triphos),成功地实现了一系列芳香族、杂芳族和脂肪族腈与伯胺、仲胺或氨的还原交叉偶联反应,高效、高选择性地构建了一系列官能团化且结构多样的胺类产物(> 230种),其中包括药物活性分子、手性分子和N -甲基化产物。此外,该方法还能实现药物分子、天然产物和结构复杂化合物及其中间体的后期修饰。相关成果发表在Science 上。
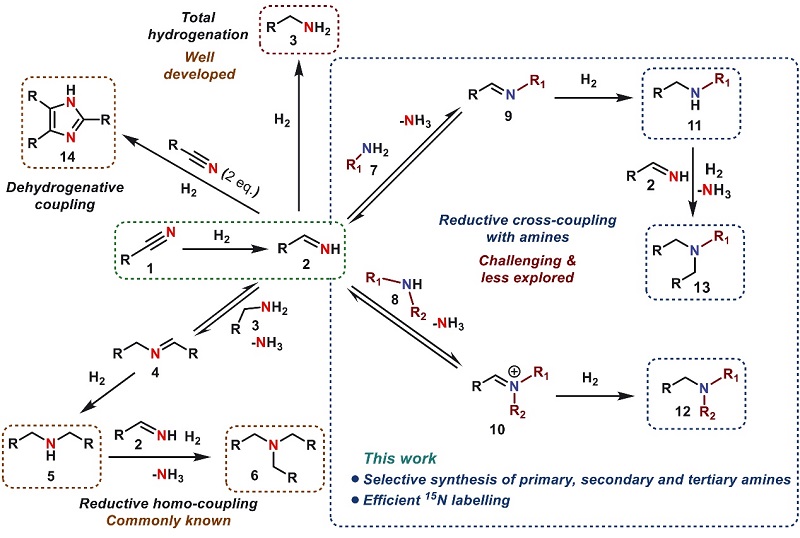
图1. 腈与伯胺、仲胺或氨的催化还原交叉偶联。图片来源:Science
近年来,多齿膦作为特殊的配体骨架被科学家用来制备具有特殊催化活性的金属配合物,并被广泛用于多种条件严苛的氢化反应,例如酯氢化成醚、二氧化碳氢化成甲醇、羧酸氢化成醇、酰胺氢化成胺等。基于上述工作,作者以4-甲基苯甲腈(15)和4-茴香胺(16)为模型底物来研究3d 金属与选定的二齿、三齿和四齿膦配体组合的反应性能(图2),结果显示原位生成的Fe和Mn配合物在模型反应中具有较低的催化活性或无催化活性,而在Ni-L1的存在下能以优异的收率(91%)和选择性获得产物17,并且只有Ni(OTf)2和Ni(BF4)2·6H2O的催化活性较高,而其它镍盐需在L1和Zn(OTf)2的共同存在下才具有优异的催化活性。进一步对配体、催化剂负载量、温度、H2压力、溶剂等进行筛选后,得到了最佳反应条件:即15和16在Ni-L1为催化剂、三氟乙醇(TFE)为溶剂的条件下于100 ℃、40 bar H2气氛下进行反应,能以优异的收率(91%)和选择性获得产物17。
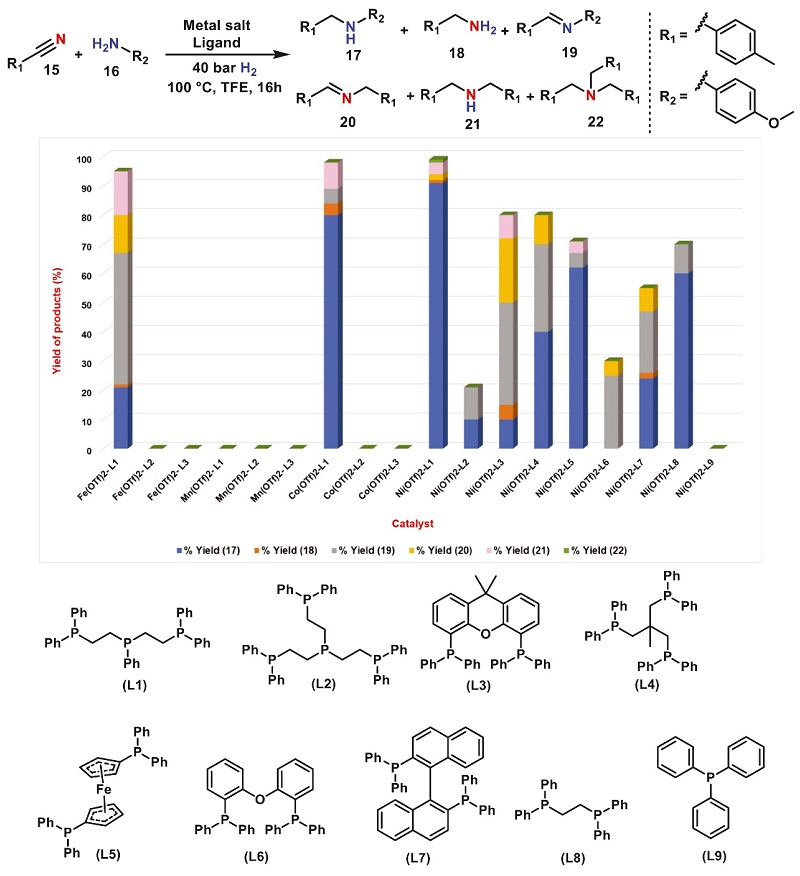
图2. 金属-膦配合物的条件筛选。图片来源:Science
其次,作者还制备了Ni(OTf)2-L1 配合物A并对其进行表征,X-射线衍射分析显示A是由一个膦配体(Ni:L1 = 1:1)和一个三氟甲磺酸基团与Ni 中心进行配位,并且分离出的配合物A与原位产生的配合物具有相似的活性和选择性。此外,作者在最佳条件下监测了不同时间段模型反应的进展,揭示了仲亚胺19 的形成对该反应具有重要意义,并且仲亚胺19的高选择性氢化是该反应的决速步骤,而该反应主要有四个基本反应步骤:即腈 15 的催化还原生成不稳定的中间体伯亚胺 15A,后者与茴香胺 16 加成形成缩醛胺15B,接着消除一分子氨生成仲亚胺 19,随后经选择性还原即可生成所需的仲胺 17。值得注意的是,腈氢化速率和亚胺的形成速率都比17的生成快,而因伯亚胺15A加氢速度比交叉偶联步骤慢导致该反应具有优异的化学选择性。
在最优条件下,作者对该反应的底物范围进行了考察。如图3A所示,不同基团取代的芳香族(如空间位阻较大的2,6-二甲基苯甲腈(24)、卤代苯甲腈(26-33)、二/三取代的苯甲腈(30-33、36-37)、含有可还原官能团(如(硫)醚、酯、酰胺、硼酸酯等)的苯甲腈(39-42))、杂环族腈(如:吡啶(43-45)、呋喃(46)、苯并二氧戊环(47)和1,3-二氢异苯并呋喃(48))和脂肪族腈(49-55)均能与茴香胺或苯胺进行氢化交叉偶联反应,并以良好至优异的选择性和收率获得相应产物。此外,一系列结构多样的伯胺(56-88)也能顺利地实现这一转化(图3B),同时多种仲胺(包括吲哚)也能以高达94%的收率获得相应的叔胺产物(89-95)。值得一提的是,α-甲基胺也能与不同的腈进行反应(图3C),以82%-91%的收率得到所需产物(96-100)。然而,亲核性较低的芳族仲胺以及空间位阻较大的腈和胺反应效果却不好,所需产物的收率很低甚至没有。其次,Ni-L1体系还能有效地催化芳香腈与二甲基胺/甲基胺的反应(图4A),并以良好至优异的收率和选择性获得相应的N-甲基化产物(101-139),后者广泛存在于众多药物分子和生物活性化合物中。此外,多种不同骨架的脂肪族腈(120-124、137、138)甚至二腈(139)也可兼容该反应。
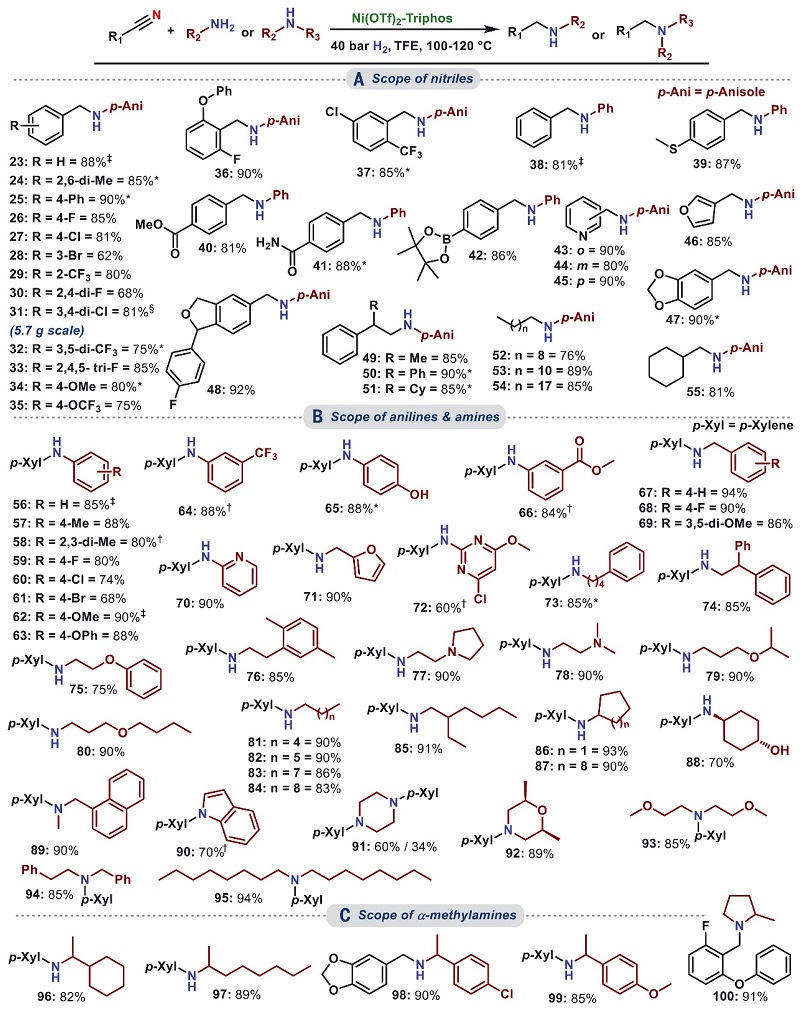
图3. 腈和胺的氢化交叉偶联合成仲胺和叔胺。图片来源:Science
接下来,作者尝试以NH3为胺源来实现由腈合成伯胺的设想,初步研究发现在标准条件下会形成大量腈自偶联产物(21,收率85%)和少量叔胺产物(22,收率10-12%),而将温度升至120 ℃时能以87%的收率获得所需的4-甲基苄胺18。为了进一步了解NH3的作用,作者在15N-标记乙酸铵的存在下进行氢化反应,LCMS和NMR分析显示主要形成15N-标记的4-甲基苄胺(收率86%;15N/14N-选择性分别为89%和11%),这表明NH3与4-甲基苯基腈15并不是简单的氢化反应,而是通过还原偶联进行的。另一方面,在15的氢化反应中添加不同当量15N-标记的乙酸铵会有不同程度15N-标记产物的生成,此结果也暗示了15N-标记和未标记的亚胺是通过相应的缩醛胺达到平衡。在此基础上,作者对Ni-triphos催化的腈和NH3氢化偶联反应的底物范围进行了探究(图4B),结果显示单/双/三卤代苯甲腈(144-146、156-163)、基于吡啶、噻唑、苯并三唑、呋喃等杂环腈(164-174)以及不同结构的脂肪族腈(175-186、191-192)均能兼容该反应,以较好的收率和选择性构建多种伯胺。需要指出的是,该方法还可利用不同腈与15NH4OAc的反应来制备各种15N-标记的伯胺并且15N-标记高达91%(图4C,195-204),这对探索生物活性化合物的代谢过程具有重要意义。
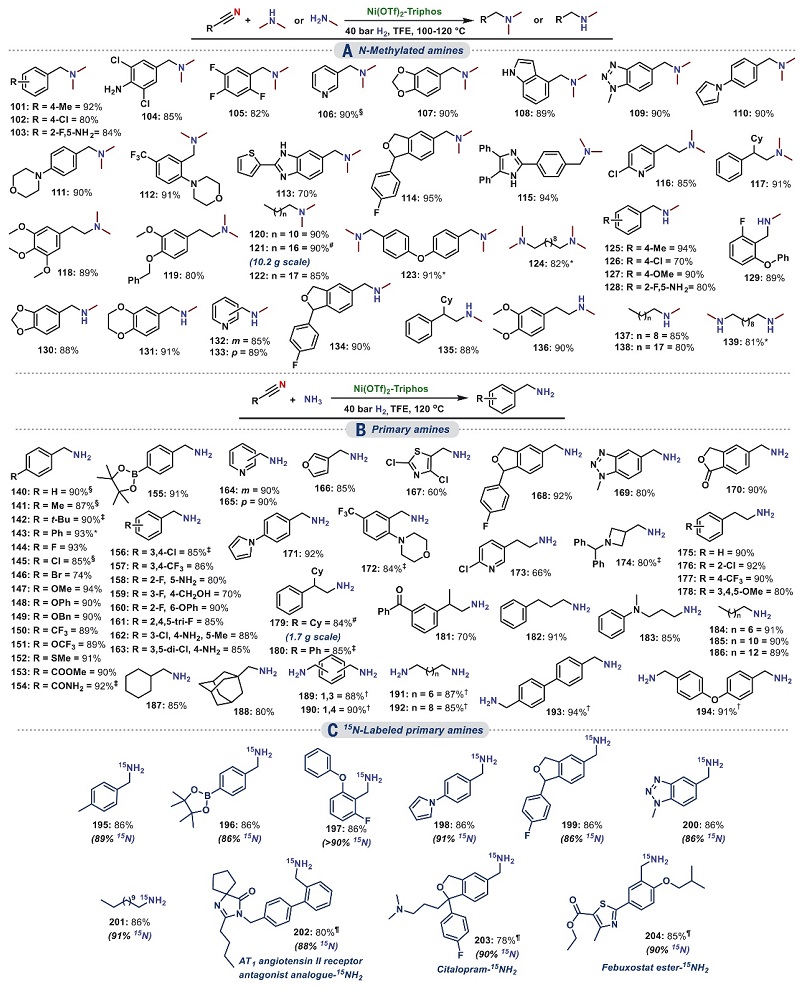
图4. 腈与N-甲胺和氨的氢化交叉偶联。图片来源:Science
为了突出该催化体系在药物分子和复杂结构分子中的适用性,作者研究了手性胺与腈的氢化交叉偶联反应。如图5A所示,各种不同类型的手性伯胺和仲胺均能与腈进行反应,从而成功地构建了一系列立体构型保持的N-烷基化手性仲胺和叔胺(205-215),尽管产物210和214观察到12-14%的外消旋化,这可能是由于2-苯基丙腈的α-H酸性较高所致。此外,Ni-triphos催化体系对13种现有药物分子的制备同样有效(图5B,216-228),例如利用手性伯胺制备可治疗继发性甲状旁腺功能亢进症等症状的西那卡塞和tecalcet(223-224)。
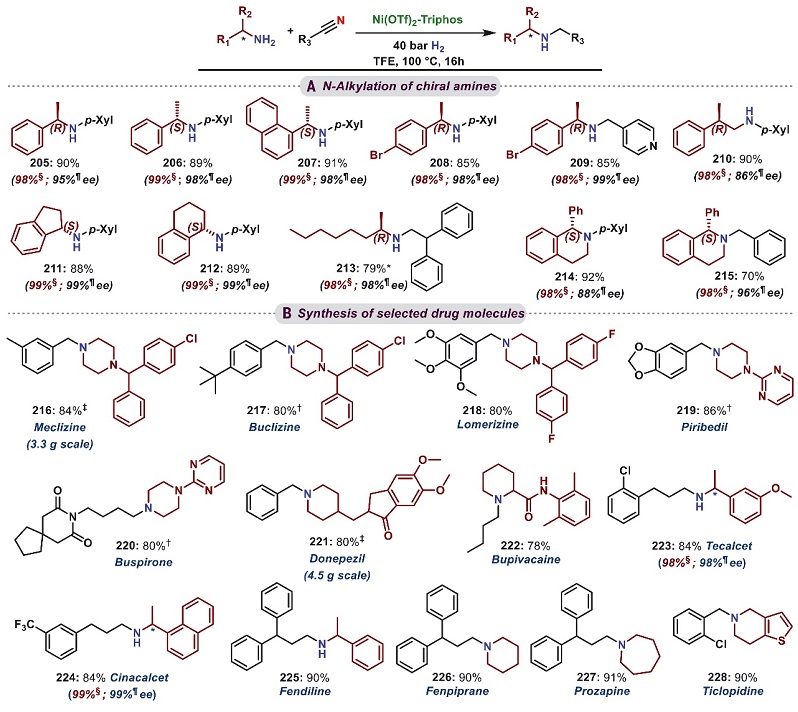
图5. 手性胺与腈的N-烷基化以及药物分子合成中的适用性考察。图片来源:Science
最后,作者还将该策略用于具有特殊生物活性的药物分子、天然产物和结构复杂化合物及其中间体的后期修饰(图6),例如氰氟草酯、西酞普兰、氨基酸类似物、血管紧张素II受体拮抗剂类似物、非布司他、来曲唑以及阿那曲唑等氰基均可与胺和氨进行反应(229-248),并且仅是氰基以高度选择性参与反应,同时不影响核心骨架。类似地,生物活性胺的衍生物(如氟西汀和地氯雷他定)也能与各种腈进行烷基化并得到相应的产物。值得注意的是,该催化策略还可以将反应规模扩大至10 g级水平(如31、121、179、216、221)。
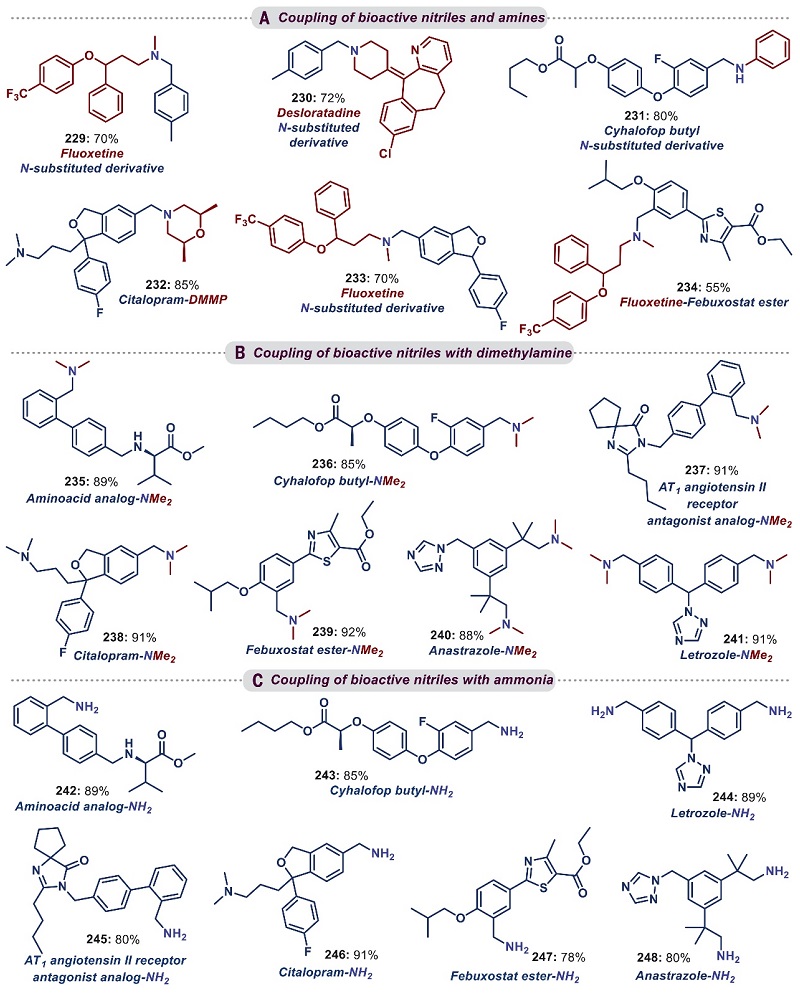
图6. 生物活性腈和胺的后期修饰。图片来源:Science
总结
本文作者利用Ni-triphos催化体系,成功地实现了多种腈和胺/氨的还原交叉偶联反应,构建了一系列功能复杂和结构多样的芳香族、杂芳族和脂肪族伯胺、仲胺和叔胺,包括 N-甲基化产物。此外,该方法对于具有特殊生物活性的药物分子、天然产物和结构复杂化合物及其中间体的后期修饰同样有效。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nickel-catalyzed hydrogenative coupling of nitriles and amines for general amine synthesis
Vishwas G. Chandrashekhar, Wolfgang Baumann, Matthias Beller, Rajenahally V. Jagadeesh
Science, 2022, 376, 1433-1441, DOI:10.1126/science.abn7565
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号