山东师范大学唐波教授、李平教授团队JACS:溶酶体粘度激活的NIR-Ⅱ荧光引导肝脏缺血再灌注损伤的精准导航

肝脏缺血再灌注损伤(HIRI)是肝脏切除手术和肝脏移植手术中不可避免的并发症,是术后肝功能障碍和肝功能衰竭的主要原因。精准、快速导航HIRI病灶对早期预警并及时制定预处理计划和策略阻止HIRI进一步的进展具有重要意义。然而,现有的肝损伤检测方法仍然无法术中实时精准定位肝脏损伤部位。HIRI与肝脏氧化应激密切相关,氧化应激能够损伤溶酶体降解功能,最终导致溶酶体粘度的显著改变。因此,溶酶体粘度有希望作为精准定位HIRI的潜在生物标志物。
基于以上背景,山东师范大学唐波教授、李平教授课题组发展了一个粘度激活型近红外二区(NIR-Ⅱ)荧光探针(NP-V)用于HIRI过程中肝细胞及小鼠溶酶体粘度的检测。作者首次揭示了在HIRI过程中活性氧(ROS)—丙二醛(MDA)—组织蛋白酶B的信号通路,进一步使用探针NP-V对小鼠HIRI病灶进行高信噪比的NIR-Ⅱ荧光成像,实现了对肝脏病灶组织轮廓与边界的清晰辨别,从而精准定位并切除炎症病灶。这一工作证实了NP-V作为双功能探针在阐明HIRI发病机制和在临床应用中引导HIRI病变部位的潜力。
相关工作以”Precision Navigation of Hepatic Ischemia−Reperfusion Injury Guided by Lysosomal Viscosity-Activatable NIR-Ⅱ Fluorescence”为题发表在国际权威杂志Journal of the American Chemical Society上,并入选Supplementary Cover。该项研究工作也是唐波教授、李平教授课题组于2013年在Journal of the American Chemical Society(J. Am. Chem. Soc., 2013, 135, 14956-14959)上发表关于肝脏缺血再灌注损伤中超氧阴离子自由基波动的动态和可逆荧光成像的工作之后,在肝脏缺血再灌注损伤研究方面取得的又一个突破性研究结果。
简单介绍:
该荧光探针NP-V表现出卓越的优点,包括在864 nm处13倍的荧光“off-on”响应、在NIR-Ⅱ窗口存在明显的荧光开启(图1)及良好的生物相容性。此外,NP-V在肝细胞溶酶体内积累,呈现红色点状荧光(图2)。
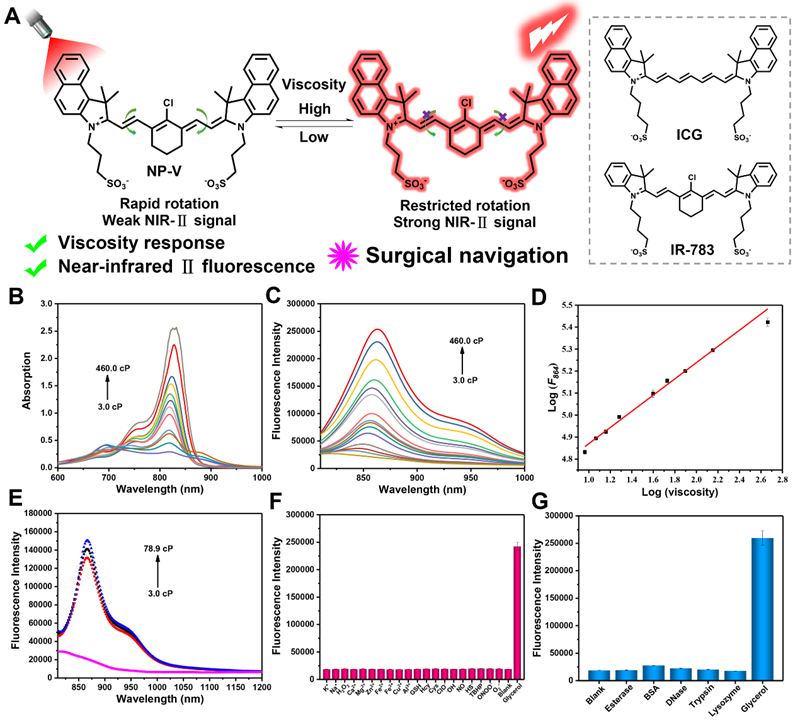
图1 粘度响应型NP-V的结构和荧光性质。(A)粘度发光机理及ICG与IR-783的化学结构。(B)不同粘度的水-甘油体系中NP-V的吸收光谱。(C)NP-V在不同粘度的水-甘油体系中的荧光光谱。(D)logF864与logη之间的线性关系。(E)NP-V在810-1200 nm波长范围内对不同粘度的NIR-Ⅱ荧光响应。(F)NP-V对不同ROS,RNS和金属离子的荧光响应。(G)NP-V对体内丰富的酶的荧光响应。
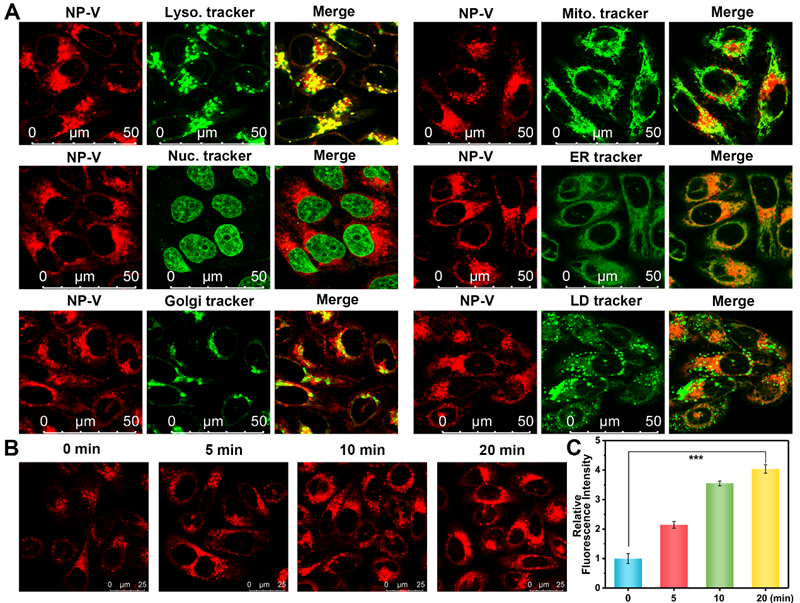
图2 NP-V的亚细胞定位及荧光成像肝细胞粘度变化。(A)肝细胞共孵育NP-V(红色通道)与相应的细胞器靶向染料(绿色通道)的共定位图像。(B)使用NP-V检测地塞米松预处理肝细胞(0, 5, 10, 20 min)后的溶酶体粘度动态变化。(C)B图的相对荧光强度输出。
NP-V成功实现了HIRI过程中溶酶体粘度变化的实时成像检测(图3)。HIRI细胞与对照组相比表现出2.9倍荧光信号增强,说明溶酶体粘度能够作为HIRI的关键指标,用来有效区分正常肝细胞与HIRI细胞。
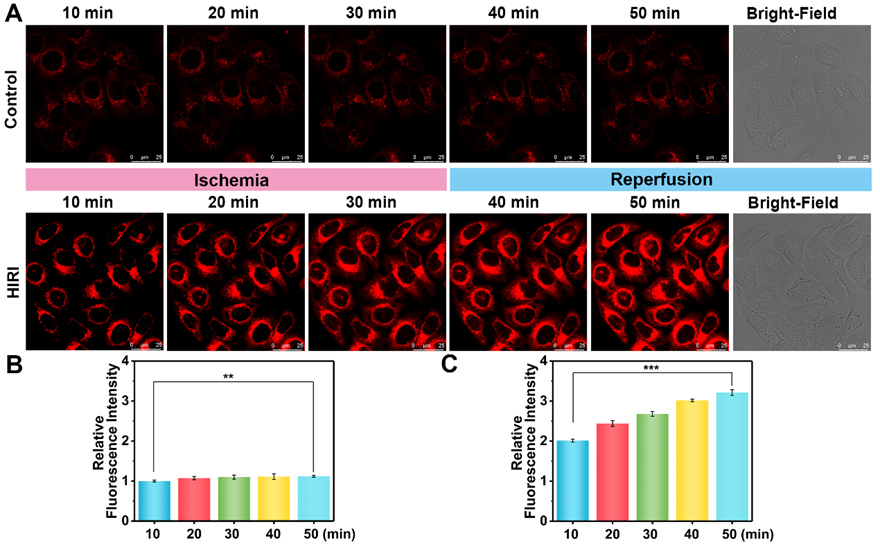
图3 HIRI过程中肝细胞溶酶体粘度的实时荧光成像。(A)在10、20、30、40和50 min时,对照组和HIRI组肝细胞溶酶体粘度的荧光图像。(B)对照组肝细胞的相对荧光强度输出。(C)HIRI组肝细胞的相对荧光强度输出。
有研究报道ROS与细胞微环境粘度密切相关。通过使用超氧阴离子(O2•−)和过氧亚硝基阴离子(ONOO−)响应型LW-OTf探针,作者发现了HIRI过程中溶酶体ROS含量显著上升,并且溶酶体过量的ROS能够调控溶酶体粘度的变化(图4)。作者进一步证实了HIRI过程中溶酶体ROS积累引起溶酶体MDA含量升高。
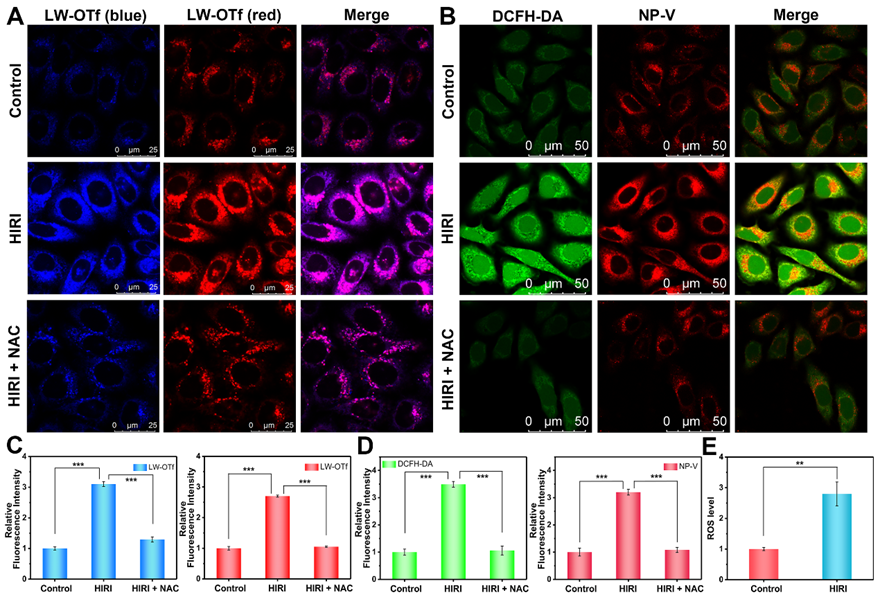
图4 HIRI期间肝细胞溶酶体ONOO−、O2•−和粘度的实时荧光成像。(A)肝细胞溶酶体ONOO−(蓝色通道)和O2•−(红色通道)的同时荧光成像。(B)肝细胞ROS(绿色通道)和溶酶体粘度(红色通道)的同时荧光成像。(C)A图的相对荧光强度输出。(D)B图的相对荧光强度输出。(E)对照组和HIRI组肝细胞溶酶体中的相对ROS水平。
接下来,作者重点研究了HIRI过程中过量MDA对下游蛋白的作用靶点。作为最丰富的溶酶体蛋白酶,组织蛋白酶B控制溶酶体中的蛋白质降解并维持微环境稳态。通过使用组织蛋白酶B活性试剂盒,作者发现HIRI组肝细胞内具有比对照组更低活性的组织蛋白酶B。联合蛋白质质谱技术对组织蛋白酶B进行蛋白质组学分析,如图5所示,在赖氨酸、组氨酸、精氨酸和天冬酰胺位点检测到了11种席夫碱和二氢吡啶MDA加合物。
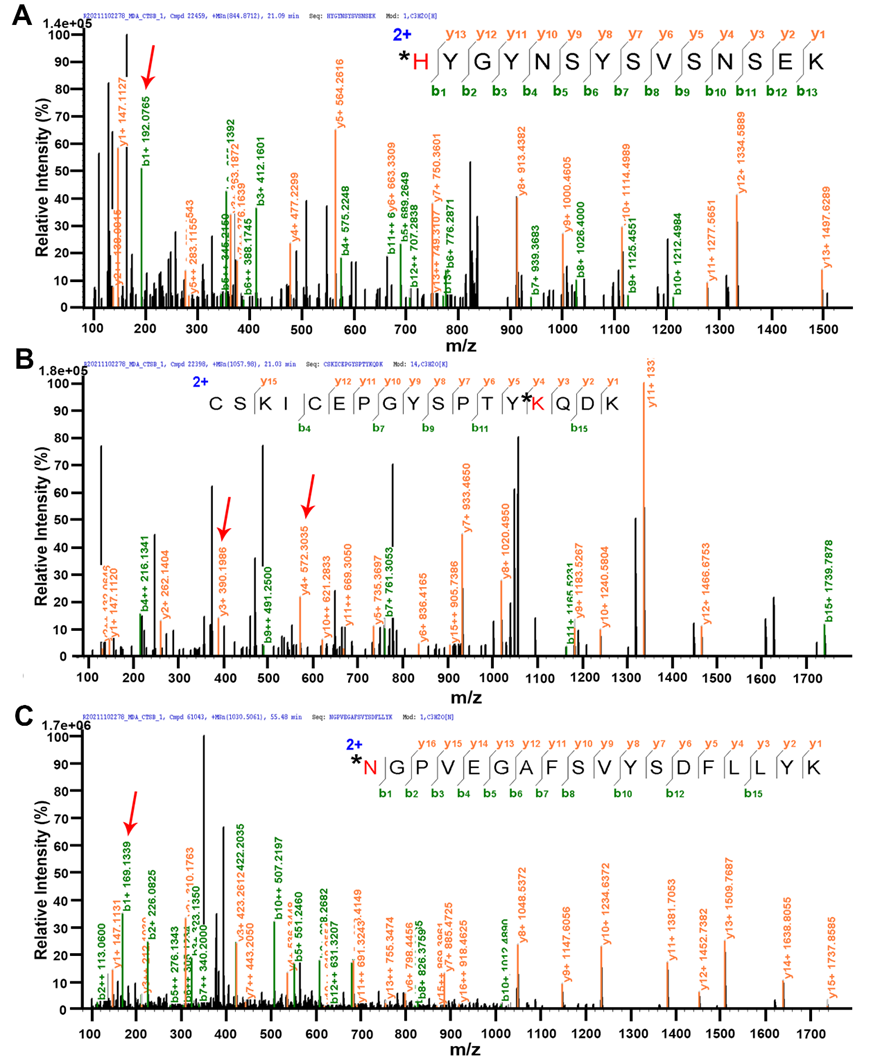
图5 组织蛋白酶B与MDA反应的蛋白质组学分析(部分图片)。在氨基酸位点H224 (A)、K220 (B)和N246 (C)上的代表性MDA 席夫碱加合物(+54 Da)。
基于以上实验,HIRI过程中溶酶体ROS—MDA—组织蛋白酶B级联信号通路介导粘度变化首次被揭示。最后,通过NIR-Ⅱ活体成像与组织病理学检查,探针NP-V用于活体小鼠内精准导航HIRI肝脏病变部位及成像指导病灶切除的能力被证实(图6)。基于溶酶体粘度的策略有潜力在肝脏学研究中进一步应用,以揭示HIRI的发生和发展,并有望用于评价HIRI药物的体内治疗效果。

图6 小鼠NIR-Ⅱ荧光成像及NIR-Ⅱ荧光成像引导下的HIRI病变切除。(A-C)精准导航和手术切除HIRI小鼠肝脏病灶部位的代表性NIR-Ⅱ荧光图像。D 离体器官的NIR-Ⅱ荧光和明场成像图使用1000 nm长通滤光片。(E)A-C图的相对荧光强度输出。(F)HIRI组小鼠肝脏切除部位(蓝色圆圈区域内)的H&E染色。(G)HIRI小鼠肺、脾、肾、心脏组织H&E染色。
本研究工作得到国家自然科学基金、山东省重点研发计划、山东省国家科学基金资助项目、中央政府引导的地方科技发展基金、英国皇家学会、国家留学基金委、巴斯大学的大力资助。衷心感谢山东师范大学唐波教授/李平教授团队、巴斯大学Tony D. James教授团队的支持。该论文第一作者是山东师范大学博士研究生刘继红。山东师范大学张雯副教授、巴斯大学吴庐陵博士、Tony D. James教授、山东师范大学李平教授和唐波教授为论文共同通讯作者。山东师范大学为第一单位。
通讯作者简介:

张雯副教授,山东师范大学
张雯,分析化学专业博士,山东师范大学副教授,硕士生导师。2015年进入山东师范大学化学化工与材料科学学院。主要从事功能小分子荧光探针的设计合成,并探索其在生物传感与成像领域的应用研究。以第一或通讯作者身份在J. Am. Chem. Soc.,Angew. Chem. Int. Ed.,Chem. Sci.,Anal. Chem.,Chem. Commun.等国际重要的学术刊物上面发表论文10余篇。

吴庐陵博士,英国巴斯大学
吴庐陵,英国巴斯大学化学系博士,博士期间在国家留学基金委及英国巴斯大学共同资助下,主要从事用于生物体内环境和疾病生物标志物的新型荧光探针开发,构建了灵敏、高选择性的活细胞成像方法并用于药物筛选。特别是基于多种逻辑与双重响应策略创新发展了针对多种目标物的同时成像分析方法。以第一和通讯作者在J. Am. Chem. Soc.,Nat. Rev. Chem.等期刊发表SCI论文23篇,包括ESI高被引5篇。曾担任Front. Chem. Sci. Eng. 和Front. Chem.期刊的客座编辑,也是JACS Au, Chem. Sci. 等期刊独立审稿人,并参编英国皇家化学会出版专著《Fluorescent Chemosensors》。

Tony D. James教授,英国巴斯大学
Tony D. James教授,英国巴斯大学化学系教授,英国皇家化学学会会员。1986年于英国东安格利亚大学获得学士学位,1991年于加拿大维多利亚大学获得博士学位,1991到1995年期间于日本Shinkai教授课题组做博士后,1995到2000年期间于英国伯明翰大学任皇家学会研究员。2013年因对日本和英国科研合作做出的杰出贡献获得了达亿瓦-艾德里安奖。长期从事分子识别,分子组装,荧光探针方面的研究,是糖识别及超分子化学方向的国际知名专家。Tony D. James教授已出版两本专著,在Nature, Nat. Chem., Chem. Rev., Chem. Soc. Rev., JACS和Angew. Chem. Int. Ed.等国际学术期刊上发表388余篇学术论文,此外拥有25项国际专利。
课题组网站:
https://researchportal.bath.ac.uk/en/persons/tony-james

李平教授,山东师范大学
李平,山东师范大学二级教授、博士生导师,享受国务院政府特殊津贴、入选百千万人才工程国家级人选、国家有突出贡献中青年专家、泰山学者、教育部“长江学者和创新团队发展计划”创新团队带头人、教育部“全国高校黄大年式教师团队”骨干成员、山东省有突出贡献的中青年专家、山东省优秀研究生导学团队负责人、山东省高校重点实验室首席专家、山东生物医学工程学会专业委员会委员、山东省科协国家级科技思想库决策咨询专家、AIMS Materials Science编委、中国致公党山东师范大学基层委员会副主委。李平教授多年来致力于新型光学功能探针的构建,以及细胞与活体内生物活性分子化学成像的研究工作,取得了一系列重要突破和研究进展。已主持完成国家重点基础研究发展计划(“973计划”)课题1项、国家自然科学基金面上项目3项、国家重大新药创制课题子课题1项、国家自然科学基金青年基金1项、山东省自然科学基金重大基础研究项目1项及山东省科技攻关项目1项。目前主持国家自然科学基金面上项目1项。相关研究成果已在J. Am. Chem. Soc.,Angew. Chem. Int. Ed.,Chem. Sci.,Anal. Chem.,Chem. Commun.等国际重要的学术刊物上面发表论文80余篇,其中影响因子5.0以上70余篇,10.0以上10余篇,论文总引用达3000余次。作为主要参与者完成的项目,先后荣获国家自然科学二等奖(3/5)、国家科技进步二等奖(8/10),山东省自然科学一等奖(2/4)、山东省自然科学二等奖(1/4)、山东省科技进步一等奖(5/8)、山东省青年科技奖以及山东高等学校优秀科研成果二等奖(1/3)等。此外,李平教授还曾获山东省教育系统女职工建功立业标兵、齐鲁最美教师——山东省教书育人楷模、山东省省级教学成果奖一等奖(9/10)、山东师大研究生教育教学成果奖一等奖(9/10)、山东师大优秀教学奖及“青年教学能手”等荣誉称号。
课题组网站:

唐波教授,山东师范大学
唐波,汉族,1964年11月生,中共党员,1994年毕业于南开大学化学系,获理学博士,化学化工与材料科学学院教授、博士生导师,南开大学兼职教授,山东大学兼职博士生导师,教育部科技委学部委员,首届十佳全国优秀科技工作者提名奖获得者(山东省唯一),973计划首席科学家,国家杰出青年科学基金获得者,“新世纪百千万人才工程”国家级人选,入选“泰山学者攀登计划”,是国家自然科学基金委员会第12、13届专家组成员,农药、医药中间体清洁生产教育部工程研究中心主任,“分子与纳米探针”教育部重点实验室主任,山东省“十二五”分析化学特色强化重点学科负责人,山东省“十二五”高等学校强化建设太阳能化学转化与储存重点实验室学术带头人,山东省精细化学品清洁合成重点实验室学术带头人;山东师范大学省级化学学科带头人、分析化学学科带头人,化学博士学位授权一级学科负责人,化学博士后科研流动站负责人,他所领导的团队是教育部“长江学者和创新团队发展计划”创新团队和山东省优秀创新团队。现主要从事分子及纳米荧光探针的合成及其在生物成像中的应用、绿色化工、荧光材料合成及太阳能化学转化与储存等方面研究工作。在理论研究领域,在Nat. Commun., J. Am. Chem. Soc., Angew. Chem. Int. Ed., Nano Lett., ACS Nano, Adv. Funct.Mater., Anal. Chem., Biomaterials, Lab Chip, Chem. Commun.等杂志发表SCI论文500余篇,影响因子大于5.0的300余篇,引用达20000余次,荣获国家自然科学二等奖1项,山东省自然科学奖一等奖1项。在应用研究方面,申请国家发明专利44项,已授权31项;荣获国家科技进步奖二等奖2项,山东省科技进步奖一等奖2项、技术发明奖一等奖1项。在国内建立高新技术产业化基地与合作基地6个,研制与开发产品40余种,取得了显著的经济效益与社会效益。唐波的研究成果引起了国内外的广泛关注,多次参加国内外学术会议,进行学术交流。主持国家重点基础研究发展计划(973)、国家自然科学基金重点项目、国家自然科学基金科学仪器基础研究专项等多项国家级项目。
课题组网站:
http://www.tangb.sdnu.edu.cn/index.htm
作者:刘继红
审核者:张雯、苏迪
上传者:刘继红
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.2c03832
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号