Angew. Chem. :以三烯化合物为潜在生源合成中间体实现多个天然乌药烷倍半萜多聚体的不对称全合成

从金粟兰科植物分离出的乌药烷倍半萜及其多聚体,因结构独特且具有良好的生物活性,成为了金粟兰科植物的标志性化合物。该类天然产物近年来引起了合成化学家们的关注,迄今为止,已有关于[2+2]型、背靠背型[4+2]型二聚体以及C11′-C15连接的二聚体shizukaol J和三聚体trishizukaol J的全合成工作报道。
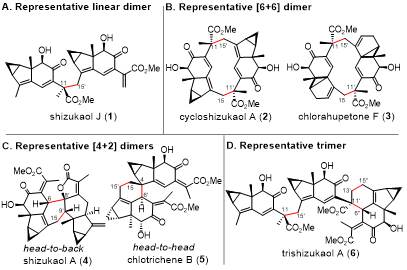
图1.代表性乌药烷倍半萜多聚体
四川大学的刘波教授课题组自2008年起,持续开展乌药烷倍半萜类化合物的合成研究,已经实现了多个该类天然产物的全合成。最近,作者通过特殊策略,合成得到被广泛接受但尚未证实的生源合成三烯中间体TE1;以TE1为关键中间体,实现了图1所示六个天然产物的全合成,验证了生源合成途径。
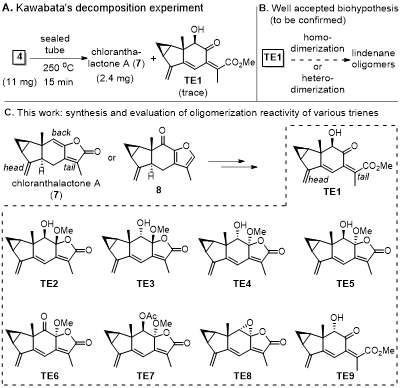
图2.生源合成假说与潜在的生源合成中间体
作者通过已知化合物7或8合成了TE1-TE9共9个三烯化合物进行了一系列二聚反应尝试。其中,TE2、TE3及TE9未能发生二聚,TE4-TE8虽然成功发生了二聚,但是所设想的endo型产物均不是主产物,考虑到目标化合物以及[4+2]型的天然产物均倾向于endo型,因此作者认为TE4-TE8不是潜在生源合成中间体。转而尝试合成TE1,经过大量条件优化后,发现TE5在碳酸钾/甲醇/-10℃条件下,可以顺利制备TE1,而浓缩后的TE1在室温下就可以缓慢二聚,得到chlotrichene B(1)以及化合物16和17。之后作者对反应条件进行了优化,发现在无溶剂/32℃/黑暗反应条件下可以实现最好的收率。与此同时,上述反应条件也会有很少量的shizukaol J 与cycloshizukaol A生成。
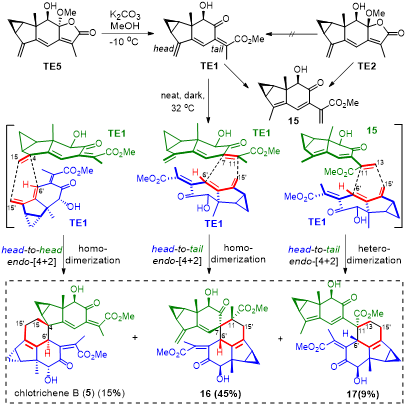
图 3 TE1的合成及其自身二聚
经过优化,发现化合物16在碱性条件下可以专一地生成shizukaol J,而在黑暗条件下60℃反应过夜则以62%的总收率和3.5:1的比例,得到shizukaol J和12元环化合物2,至此实现cycloshizukaol A的全合成,这种高效高选择性的化学键断裂和重建凸显了分子构象的重要作用。据此,也阐明了这类[6+6]型二聚体生物合成的有趣途径。 cycloshizukaol A后续可以在Ir(ppy)3存在下,经蓝光(460 nm)照射重排为5/3/6并环结构完成了chlorahupetone F的全合成。TE1分别与chloranthalactone A、shizukaol J通过Diels-Alder反应可以实现shizukaol A和trishizukaol A的全合成。
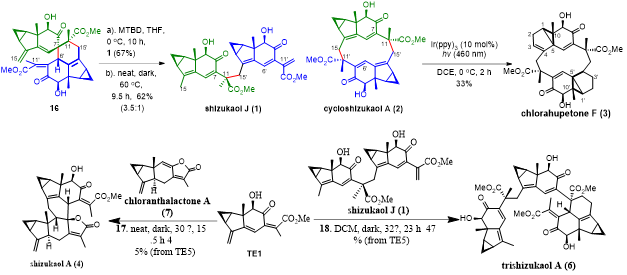
图4 天然产物cycloshizukaol A、chlorahupetone F、shizukaol A和J以及trishizhukaol A 的不对称全合成
在该工作中,刘波教授课题组在类似于植物生理环境的条件下,通过TE1的同源和异源二聚化反应完成了化合物1-6的仿生全合成。这些非酶低聚过程显示出出色的反应性和立体化学控制;其内在原因,通过与四川大学化学学院秦松教授在计算化学方面的合作,加以阐明。据此证明:TE1应是一种真正的生源合成中间体,能衍生为多种类型的乌药烷倍半萜低聚物;此时,酶在这些反应中不是必需的。活性三烯中间体TE1的发现为其他乌药烷倍半萜低聚物及其衍生物的简洁合成奠定了基础。
论文信息 Asymmetric Total Synthesis of Natural Lindenane Sesquiterpenoid Oligomers via a Triene as a Potential Biosynthetic Intermediate Zhengsong Huang, Ganxing Huang, Xiao Wang, Prof. Dr. Song Qin, Prof. Dr. Shaomin Fu, Prof. Dr. Bo Liu 论文第一作者为博士生黄正松,论文工作得到国家自然科学基金委资助。 Angewandte Chemie International Edition DOI: 10.1002/anie.202204303 点击 “ 阅读原文 ” ,可直达阅读该论文原文。 Angewandte Chemie International Edition 《德国应用化学》(Angewandte Chemie)创刊于1888年,是德国化学学会(GDCh)的官方期刊并由Wiley–VCH出版。作为化学领域的权威期刊,《德国应用化学》涵盖了化学研究的各个领域,刊发包括新闻、综述、观点、通讯、研究论文等在内的各种内容。
更多精选文章
Angew. Chem. :鲍曼不动杆菌脂多糖内核心寡糖的化学合成及抗原性评价
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号