Science:氮杂芳环上“删”碳,分子设计变简单
药物研发,可以看成是一个漫长的“闯关游戏”,先导化合物要战胜重重挑战才能成功上市变身为治病救人的药物。活性不够高、化学结构不够稳定、毒性较大、选择性不好、药代动力学性质不理想……这些因素都能导致新药研发项目的失败。因此,先导化合物也需要进行优化以提升各项属性,才有可能获得最终的胜利。在分子优化过程中,药物化学家通常会迭代修改一系列母体化合物来建立构效关系,把这个化合物系列设计出来并非难事,但要想一个个地合成出来,却往往会面临巨大的挑战,尤其在化合物结构比较复杂的情况下。举个例子,六元环骨架试过了,自然就会想到试一试五元环骨架;不过,在实验室中把六元环变成五元环可不像在画图软件上“删除”一个碳那么简单,很有可能要发展完全不同的合成方案(图1A)。这种问题在药物化学家常用的“骨架跃迁(scaffold hopping)”策略中显得尤为明显。骨架跃迁,即利用计算机评估的三维分子相似性(或与靶点结合的亲和性)来预测具有不同核心骨架的同功能结构。比较一下同类药中的不同分子就能很容易地理解该策略的逻辑,例如降胆固醇治疗药物匹伐他汀与氟伐他汀,以及抗炎药依托考昔与塞来昔布(图1B),虽然看起来仅仅是六元环变成五元环,但分子核心骨架变化所带来的合成挑战却非常巨大。
近期,美国芝加哥大学的Mark D. Levin教授(点击查看介绍)课题组在Science 上报道了一种药物分子设计优化的新方法(图1C),基于光化学转化进行氮杂芳环上的“碳删除”,由喹啉骨架变为吲哚骨架,从而直接实现骨架跃迁。具体来说,喹啉N-氧化物在390 nm光照下进行选择性光解,然后经酸促进的重排得到N-酰基吲哚,再脱掉N-酰基便可得到相应的吲哚,反应的净结果是骨架上少了一个碳原子(即“碳删除”,图1D)。值得一提的是,就在去年,Mark D. Levin教授课题组还在Nature上报道过直接“氮删除”的骨架编辑策略(Nature, 2021, 593, 223-227,点击阅读详细)。
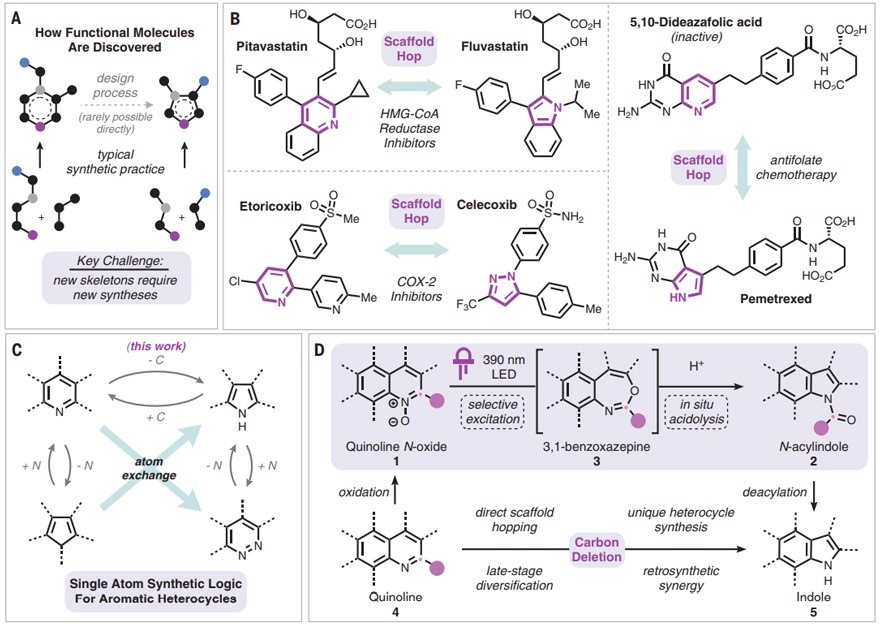
图1. 骨架跃迁和单原子骨架编辑。图片来源:Science
先前的研究表明喹啉N-氧化物(1)在汞灯照射下会发生重排并得到多种重排产物(如喹诺酮类、2-和3-酰基吲哚、3-羟基喹啉等)的混合物(图2A),有些底物也会产生N-酰基吲哚(2)及其相关的水合物。此外,许多情况下对底物结构的微小变动会导致产物分布发生剧烈变化,而且经典的汞灯照射条件与许多药物化学相关的复杂喹啉结构也不兼容。因此,作者试图使用更温和的窄光谱光源来避免双光子副产物的产生。如图2B所示,当2-甲基喹啉N-氧化物(1a)在390 nm发光二极管(LED)的照射下于室温进行反应时,能以91%的NMR产率得到相应的benzoxazepine(3a)以及少量的脱氧产物4a(3a:4a = 15:1)。尽管3a不可分离,但氰基取代的benzoxazepine(3b)易分离(产率:83%),并且3b在LED的照射下比在汞灯照射下更稳定(图2C),前者照射6 h后几乎还可定量回收,而后者近一半的原料分解。此外,作者通过1b和3b的吸收光谱揭示了这种光源效应的起源(图2D),虽然喹啉N-氧化物在386 nm处具有最大吸收波长,但benzoxazepine的最大吸收波长显著降低至323 nm,因此LED实现了对起始原料的选择性照射,而汞灯则促进了benzoxazepine的光解。随后,作者将1a反应后得到的粗产物置于三氟乙酸下进行水解,以两步78%的产率得到所需的N-酰基吲哚2a。为了确定质子化benzoxazepine转化成产物的机制,作者进行了18O标记实验,结果显示在水解过程中同位素标记大量保持但不完全保持,这一结果与benzoxazepine水解的两个平行途径相一致(图2E)。
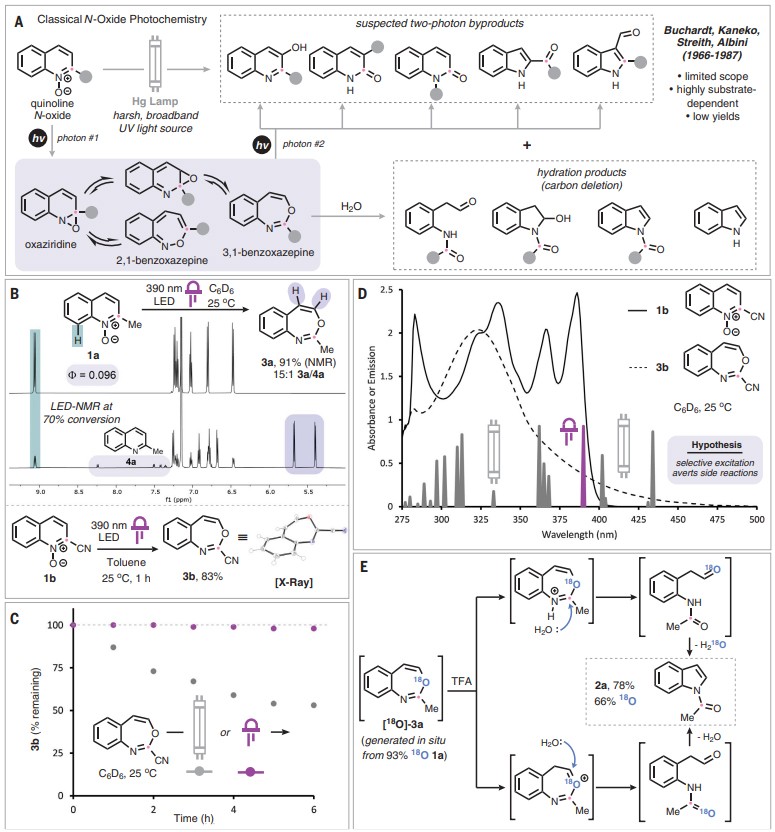
图2. 机理研究。图片来源:Science
接下来,作者对该反应的底物范围进行了考察(图3),结果显示喹啉2-位上不同官能团化(如CN、COOMe、Ph、杂芳基、烯基、烷基等)的底物均能实现这一转化,以良好的产率得到所需的N-酰基吲哚(2b-2l)。此外,这种转化还能够耐受多种药物化学中常见的官能团,例如杂芳基(2d、2e、2f、2g和2i)、多卤化(2v、2w和2x)、氨基甲酸酯(2y、2z、2aa和2ab)、膦酸酯(2o)、砜(2s)和硼酸酯(2q)。相比之下,在考察的12种喹啉中,当使用汞灯进行初始光解时,只有5种底物能产生可检测的吲哚产物并且产率显著降低(3%-13%),其余7种底物则得到难以处理的混合物。值得一提的是,该策略还能实现一锅法制备,即将喹啉底物4a置于二氯甲烷中用过氧化氢进行氧化形成相应的喹啉N-氧化物,然后将反应混合物用甲苯(95:5)进行稀释并进行辐照、TFA酸化,能以69%的产率得到相应的N-酰基吲哚2a;而从纯化N-氧化物出发的两锅法策略的产率为78%,这意味着一锅法策略的产率仅略微降低。
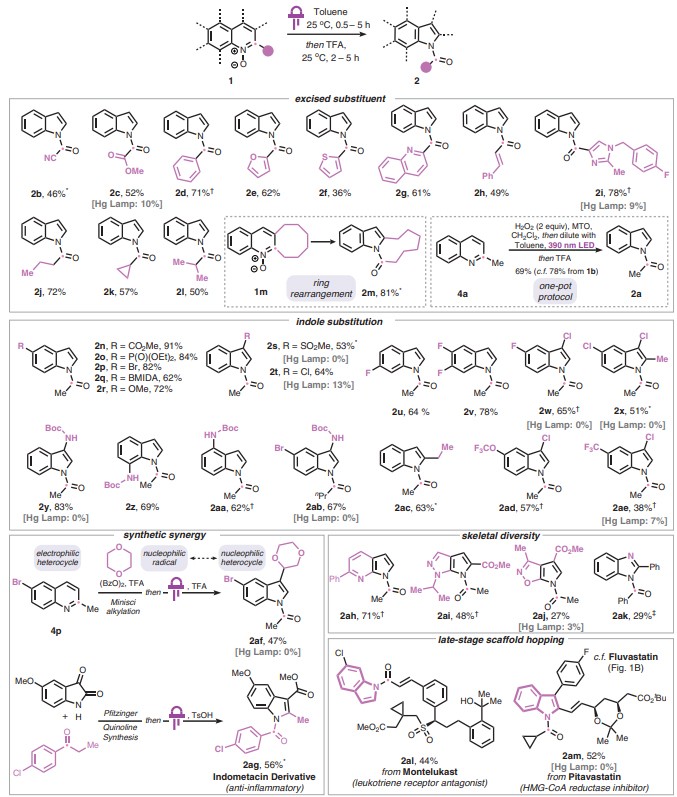
图3. 底物范围。图片来源:Science
此外,该方法还能实现缺电子喹啉和富电子吲哚杂环之间的转化。具体而言,从喹啉4p出发,先在母体喹啉的4-位进行Minisci烷基化,接着进行光照、TFA酸化便可以47%的产率得到相应的富电子吲哚2af(净结果是亲核吲哚产物的3-位烷基化),而先前的方法则难以实现这一转化。另一方面,靛红衍生物和酮通过Pfitzinger反应得到喹啉4ag,然后经本文发展的方法便可以56%的产率得到消炎药吲哚美辛的衍生物2ag。类似地,该策略还能通过母体稠环吖嗪的净碳删除来制备相应的7-氮杂吲哚(2ah)、吡咯并吡唑(2ai)、吡咯并异噁唑(2aj)和苯并咪唑骨架(2ak),而通过传统的杂环合成法来制备这些5,5-稠合体系却极具挑战性。为了进一步突出该方法的实用性,作者展示了其在复杂药物分子后期修饰中的应用。从广泛使用的白三烯抑制剂孟鲁司特(Singulair)出发,侧基上的氯喹啉可以转化为相应的酰基吲哚2al;也可以实现匹伐他汀到其吲哚同源物2am的直接骨架跃迁,这样就能通过碳删除在化学骨架上与氟伐他汀建立联系。
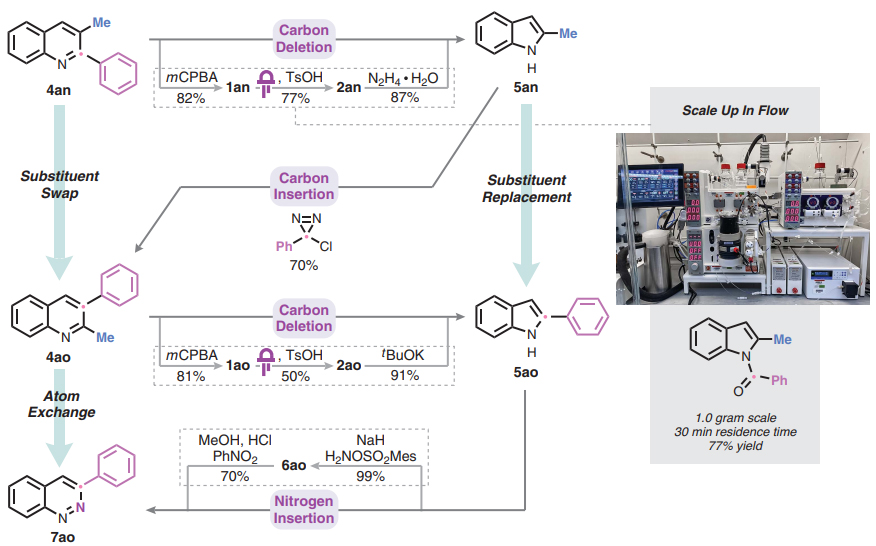
图4. 碳删除是更复杂骨架跃迁策略和光化学重排流动放大之间的跳板。图片来源:Science
最后,作者展示了如何利用简单的模型系统将碳删除作为更复杂骨架跃迁策略的基础。如图4所示,从喹啉4an开始,经碳删除得到吲哚5an,并且在流动化学中可将光重排反应扩展至1 g规模。随后,应用先前报道的C3-选择性碳插入反应得到异构的喹啉4ao,其C2和C3取代基相对于起始原料4an已发生形式交换。此外,该喹啉4ao还可以再次进行碳删除以得到吲哚5ao,相对于前体5an实现了甲基与苯基的有效取代。最后,如果吲哚5ao通过先前的N-胺化和氧化芳构化序列进行氮插入,便可以得到cinnoline 7ao,这是起始喹啉4ao的形式C-to-N交换产物。
总结
Levin教授课题组通过喹啉(及相关氮杂芳烃)N-氧化物的缩环,实现了广泛适用、C2选择性的喹啉(及相关氮杂芳烃)净碳删除。该反应不仅底物范围广、官能团耐受性好,而且通过选择性的光激发可以避免有害的过度反应,使经典的N-氧化物光化学也可适用于药物化学,并进一步展示了通过碳删除转化实现直接骨架跃迁的潜力。相信这种直接对分子骨架进行编辑的碳删除策略能带来更多的药物发现成果。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Scaffold hopping by net photochemical carbon deletion of azaarenes
Jisoo Woo, Alec H. Christian, Samantha A. Burgess, Yuan Jiang, Umar Faruk Mansoor, Mark D. Levin
Science, 2022, 376, 527-532, DOI: 10.1126/science.abo4282
导师介绍
Mark D. Levin
https://www.x-mol.com/university/faculty/311435
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号