瓣蕊花生物碱的全合成,Shenvi团队先Science后Nature
GB生物碱来自热带雨林瓣蕊花属树木(Galbulimima sp.)的树皮,具有多种神经活性,在巴布亚新几内亚的传统医学中被用作镇痛剂、解热剂和致幻剂。如图1a所示,瓣蕊花(GB)生物碱可依照哌啶与十氢化萘结构之间的连接性分为4个大类(即I-IV类)。近年来,科学家对12种GB生物碱进行了体内检测,其中10种均可在不高于10 mg/kg水平上引起哺乳动物不同的生理或行为变化。另外,hembacine(I 类)对毒蕈碱受体M1到M5能产生有效的拮抗作用,因此可作为治疗心动过缓、阿尔茨海默病和眼内压的候选药物。目前,科学家研究发现GB18可影响小鼠行为,并表现为精神作用,该作用机制引起了广大科学家的兴趣,但因GB18提取不易,后续的生物活性及作用机制研究大受局限。此外,himbacine和GB18均属I类生物碱(分别表示为Ia和Ib),因此可以将GB18与himbacine的结构变化、功能与受体亲和力的变化以及选择性等相类比(图1b),从而改善GB18的全合成,这将对GB18的药效作用及其机制的研究具有重大的意义。
今年3月,美国斯克利普斯研究所(Scripps Research)的Ryan A. Shenvi教授(点击查看介绍)团队在Science 上报道了选择性自由基交叉偶联和芳烃还原策略,以“类似星际旅行”的思路,成功地实现了GB22、GB13和himgaline的简明全合成(Science, 2022, 375, 1270-1274,点击阅读详细)。近日,Shenvi教授团队在Nature 上再次发表GB生物碱全合成工作,他们以化学选择性骨架组装、配体控制立体选择性的亲电交叉偶联以及连接环的非对映选择性氢化为关键步骤,成功地实现了GB18的克级规模全合成。值得一提的是,GB18可作为κ-和μ-阿片受体的有效拮抗剂,这是近35年来GB 生物碱首次发现新作用靶点。这些结果为进一步研究Galbulimima 代谢物的生物活性奠定了坚实的基础。如图1b所示,其逆合成分析如下:GB18可由关键砌块2中所含吡啶环的立体选择性氢化得到,2可通过砌块3的交叉偶联制备而成,而砌块3则可通过烯酮4的Danheiser环化以及后期卤代获得。此外,该路线还可迅速进入GB生物碱的化学空间,并为探索对映体系列、各种杂环附环类似物和核心官能团的GB生物碱及其类似物的合成和靶点研究具有重要的研究价值。
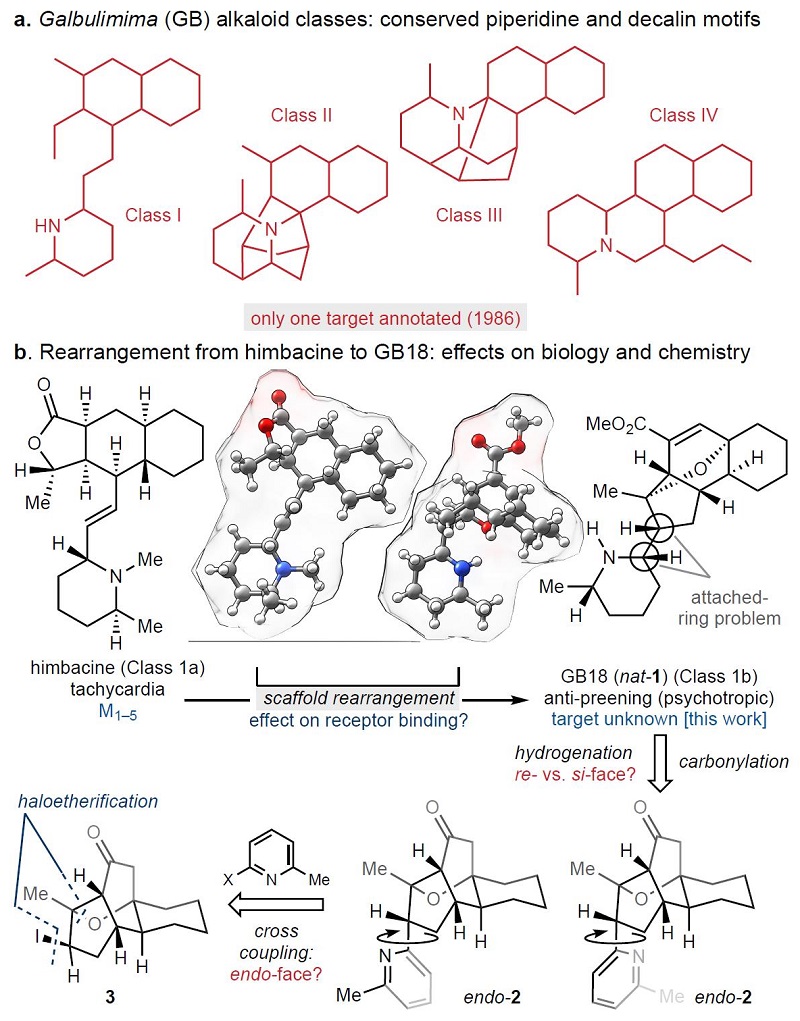
图1. GB生物碱结构分析与合成。图片来源:Nature
基于上述分析,作者以烯酮5为原料,经过氧化氢介导的环氧化和Pd/C立体选择性氢化获得砌块6,再经双甲硅烷基化反应以较好的区域选择性(95:5 Δ2,3: Δ1,2)获得中间体7,接着在Larock改良的条件下进行Saegusa氧化得到关键的烯酮砌块4。随后,砌块4与联烯在TiCl4的作用下以优异的立体选择性进行Danheiser环化,接着原位添加HFIP进行去甲硅烷基化便可获得砌块8,然后在HFIP中使用NIS进行碘醚化反应,便能以克级规模(5.6 g,收率:82%)获得关键的中间体β-卤代醚3(X-Ray证实其具有与1相同的四环骨架)。最后,作者希望借助Giese加成实现β-卤代醚3的C-I键均裂来制备砌块2,但其仅可与作为溶剂的TMS-乙炔反应生成非对映之比接近1:1的产物9。
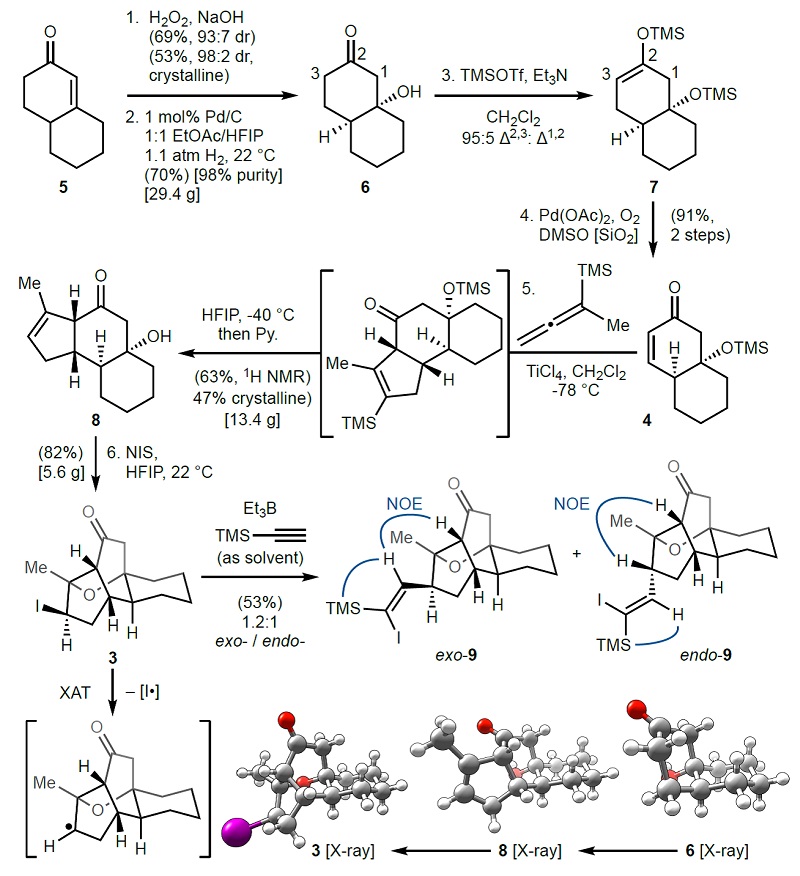
图2. GB18的合成。图片来源: Nature
接下来,作者利用β-卤代醚3与2-甲基吡啶、2-甲基吡啶 N-氧化物或 N-甲氧基-2-甲基吡啶之间的Minisci型反应也没有得到产物2,甚至是过渡金属介导的3和C2金属化吡啶(Mg、Zn)之间的交叉偶联也无所需产物的生成。受Weix、Reisman等人开发的亲电交叉偶联等工作的启发,作者试图利用光氧化还原催化和Ni催化的杂芳基还原偶联来制备砌块2,但是产率较低且在Ni催化体系中获得了少量易鉴别的吡啶二聚化、E1cB醚裂解(13)、脱碘醚裂解(8)和3的原位脱卤化等副产物。基于近期烯烃加氢官能团化工作的启发,作者利用金属氢化物氢原子转移(MHAT)与Ni催化交叉偶联相结合(即Mn(dpm)3/PhSiH3还原体系)的策略来构建砌块2并进行了条件优化(图3b),最终以高选择性(10:1 dr)和72%的收率获得所需产物endo/exo-2,并且能以克级规模进行制备。此外,尽管endo-2比exo-2(MM2)不稳定(0.5 kcal/mol),但是将产物重新置于偶联条件下却没有观察到差向异构化。
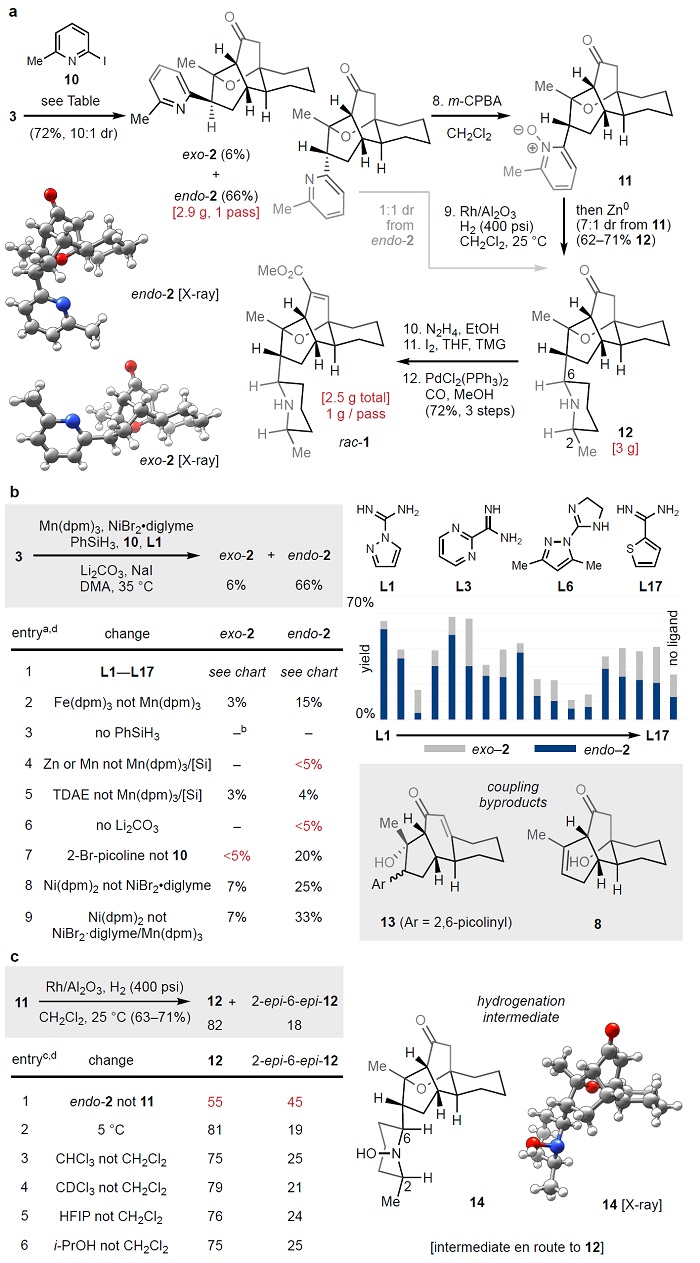
图3. 克级规模制备 rac-GB18(rac-1)。图片来源:Nature
随后,作者直接在Rh/Al2O3和氢气的作用下对endo-2进行选择性氢化,但因endo-2连接的吡啶环可自由旋转至不同前手性平面被氢化,仅以1:1 dr值获得产物(12/2-epi-6-epi-12)。为了锁定吡啶环的构象,作者通过吡啶质子化、氢键供体以及螯合Lewis酸和吡啶-N-氧化物等策略实现选择性氢化,仅有吡啶-N-氧化物11(由吡啶氧化得到)可控制吡啶环的前手性面以进行非对选择性氢化,并以克级规模和7:1的dr值构建砌块12。值得一提的是,N-O键对氢解的选择性可通过N-羟基哌啶14证明,可以通过添加Zn原位还原获得12(图3b)。在解决了三个主要挑战(即复杂的多环烯酮、高张力环醚和邻位立体中心连接氧杂四环凹面的哌啶环)后,作者从砌块12出发,经Barton碘化、钯催化的羰基插入完成了rac-1的全合成且能以克级规模制备,接着通过制备型手性SFC分离、结晶便可获得两种对映异构体((+)-nat-1和(-)-ent-1)。
先前研究发现GB-18对小鼠行为有抑制作用且对痛阈并无影响,因此作者应用NIMH 精神活性药物计划对nat-1和ent-1进行了筛选,以确定通常参与中枢神经系统调节的人类受体中的高亲和力靶点(图4a),尽管nat-1在10 μM时与43种常见药物靶点的结合力低或无统计学意义,但其与κ-阿片受体(KOR)和μ-阿片受体(MOR)具有较强的亲和力。后续TANGO分析确定nat-GB18是KOR(IC50 = 9 nM)和MOR(IC50 = 12 nM)的有效拮抗剂(图4b,红色曲线),其与吗啡衍生物纳曲酮具有相当的作用效果(图4b,蓝色曲线)。GB18 的高亲和力受体 MOR 和 KOR 的确定,为近35年来GB 生物碱新靶点的首次发现。
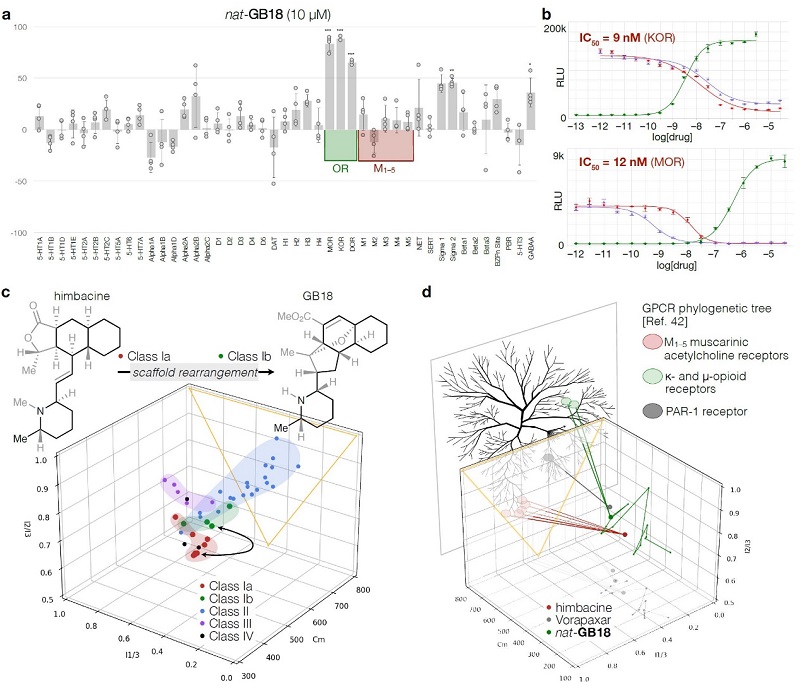
图4. GB18高效靶向受体的鉴定。图片来源:Nature
总结
Shenvi教授团队以化学选择性骨架组装、配体控制立体选择性的亲电交叉偶联以及连接环的非对映选择性氢化为关键步骤,成功地实现了GB 18的克级规模全合成。该路线可迅速进入GB生物碱的化学空间(图4d),并为探索对映体系列、各种杂环附环类似物和核心官能团的GB生物碱及其类似物的合成、靶点以及结构与功能等多方面的研究拓宽了道路。此外,他们还鉴定了GB18 的高亲和力受体 MOR 和 KOR,这对于此后的生物活性及作用机制研究有着重要意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis and target annotation of the alkaloid GB18
Stone Woo, Ryan A. Shenvi
Nature, 2022, DOI: 10.1038/s41586-022-04840-9
导师介绍
Ryan A. Shenvi
https://www.x-mol.com/university/faculty/691
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号