Nat. Chem.:三取代烯烃也可交叉复分解
含氟有机化合物凭借其独特的性质(如:增强代谢稳定性、脂溶性、膜通透性、生物可利用度以及结合亲和力等),广泛应用于农药、医药以及材料科学等领域中。据统计,全球约20-25%的医药分子和30%的农药分子中至少含有一个氟原子。如图1a所示,当Leu-脑啡肽的酰胺键被三取代烯基氟取代后,代谢稳定性和理化性质得到明显的改善,从而提高了口服生物利用度和在中枢神经系统中的分布。尽管目前化学家已经发展了一系列不同的合成方法来制备含氟有机化合物,但是仍缺乏一种普适的立体选择性生成三取代烯基氟化物的策略,这是因为选择性合成往往只生成一种异构体。相比之下,两种烯烃之间的交叉复分解或许是一种可行的策略。例如,2-氟丙烯酸甲酯和脂肪族单取代烯烃在钌络合物的催化下能以高效率(TON高达175)和高立体选择性制备许多Z-三取代烯基氟化物(图1b),但是该反应仍存在一定的局限性,许多有用的极性基团(如:伯烷基溴)都不能耐受。另外,钼催化三取代烯烃和Z-1-溴-2-氟乙烯的交叉复分解反应优先生成三取代的溴代烯(97:3 Br:F;图1c),而要想生成三取代烯基氟化物则要使用昂贵且易爆的1,2-二氟乙烯。
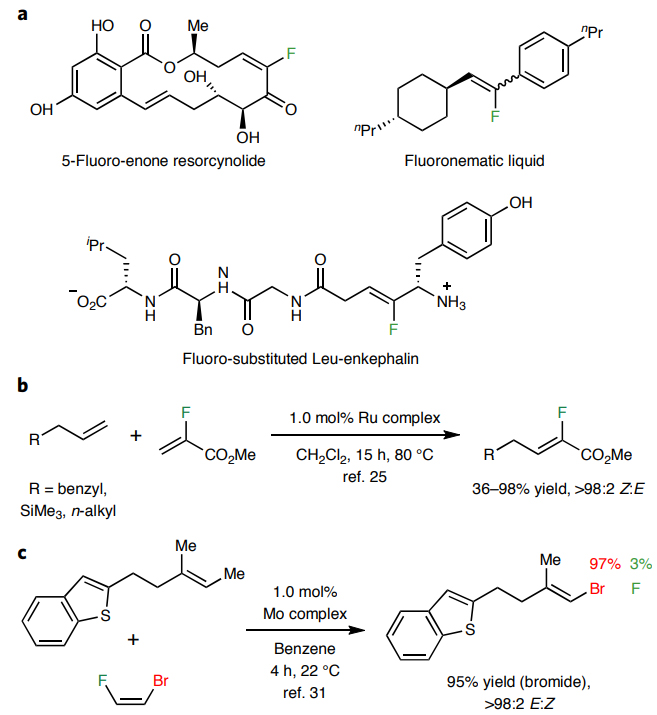
图1. 三取代烯基氟的重要性及现有的合成方法。图片来源:Nat. Chem.
近期,美国波士顿学院的Amir H. Hoveyda教授(点击查看介绍)课题组发展了一种实用且普适的催化策略,通过两种三取代烯烃之间的交叉复分解反应,立体发散性地合成了一系列带有氟、氯末端的三取代烯烃(图2a)。值得一提的是,氯、氟取代的烯烃还可以通过后续的交叉偶联在C-Cl键上进行化学选择性修饰,从而生成各种官能团化的三取代烯基氟化物。相关成果发表在Nature Chemistry 上。
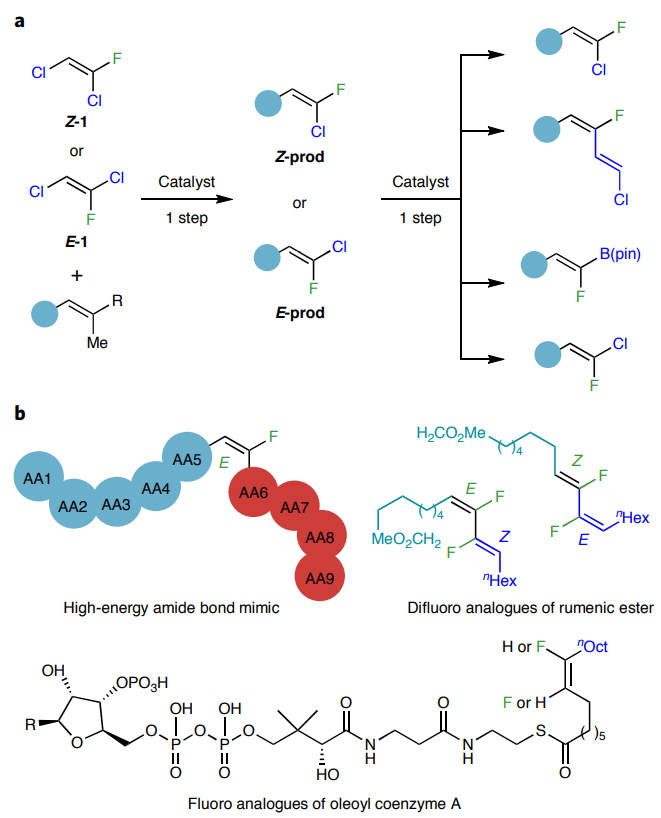
图2. 采用的策略及其机理基础。图片来源:Nat. Chem.
如图3a所示,作者首先对反应机理进行了预测。以1,2-二取代烯烃(如ia (R=H))为例,它会与钼络合物ii进行反应得到活性中间体iii,后者会与Z-1(启动速度更快)反应生成mcb-i(mcb,金属环丁烷),其中较大的氯原子朝向较小的芳基亚氨基配体,使得完全取代的碳原子位于不太拥挤的Cβ位上。随后,mcb-i发生开环便可生成氟、氯取代的烯烃(Z-prod)和氯取代亚烷基中间体iv,后者可能与1,2-二取代烯烃i进行反应。此时会有两种途径(mcb-ii(理想的途径)或mcb-iii),这取决于三取代烯烃与氯取代亚烷基中间体iv加成的区域选择性。其中经mcb-ii进行的反应将会再生亚烷基钼iii并释放出Z-1-氯-1-丙烯(挥发性副产物);而经mcb-iii转化则会得到Z-1,2-二取代的烯基氯(v)和甲基取代的亚烷基钼vi (R=H),后者可以与Z-1反应生成2,这是一种价值较低的含氟、氯取代的烯烃。事实上,将Z-1(94:6 Z:E)和Z-1,2-二取代烯烃3置于5.0 mol% Mo-1a的催化下进行反应时,得到了4a(41%转化率)、副产物5(20%转化率)和2(24%转化率)的混合物(图3b),这可能是通过mcb-iii (R=H)形成的。
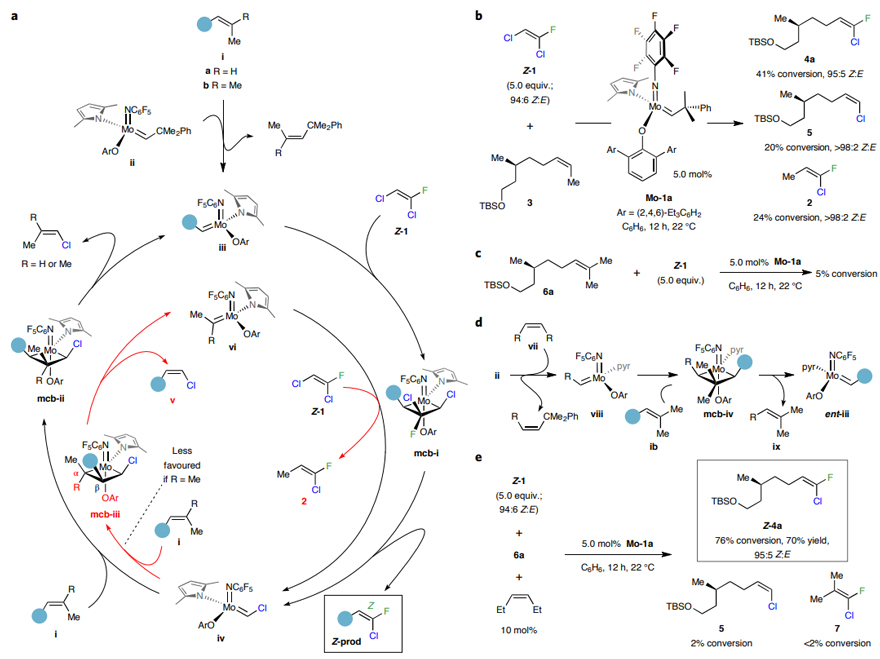
图3. 交叉复分解方法的开发。图片来源:Nat. Chem.
为了提高反应效率,必须要避免mcb-iii (R=H) 的生成。其中一种解决方案是改用三取代烯烃(R=Me),这样的话,偕二甲基在更拥挤的Cα处将不太有利。为此,作者将Z-1(5.0 equiv.)和三取代烯烃6a置于相同的条件下进行反应,但是仅观察到5%的转化率,并且大部分Mo-1a保持完整。为了促进催化剂的引发,作者向混合物中加入10 mol%的Z-1,2-二取代烯烃添加剂,这是因为生成的亚烷基(viii)会与底物分子(ib)反应得到mcb-iv,然后转化为ent-iii(图3d)。事实上,反应以76%的转化率(分离产率:70%)和95:5的Z:E比得到Z-三取代烯基氟化物(4a,图3e),并且仅观察到痕量的副产物5(2%),这表明不再有mcb-iii (R=Me) 的竞争性形成,同时过量的Z-1确保了最大转化率。
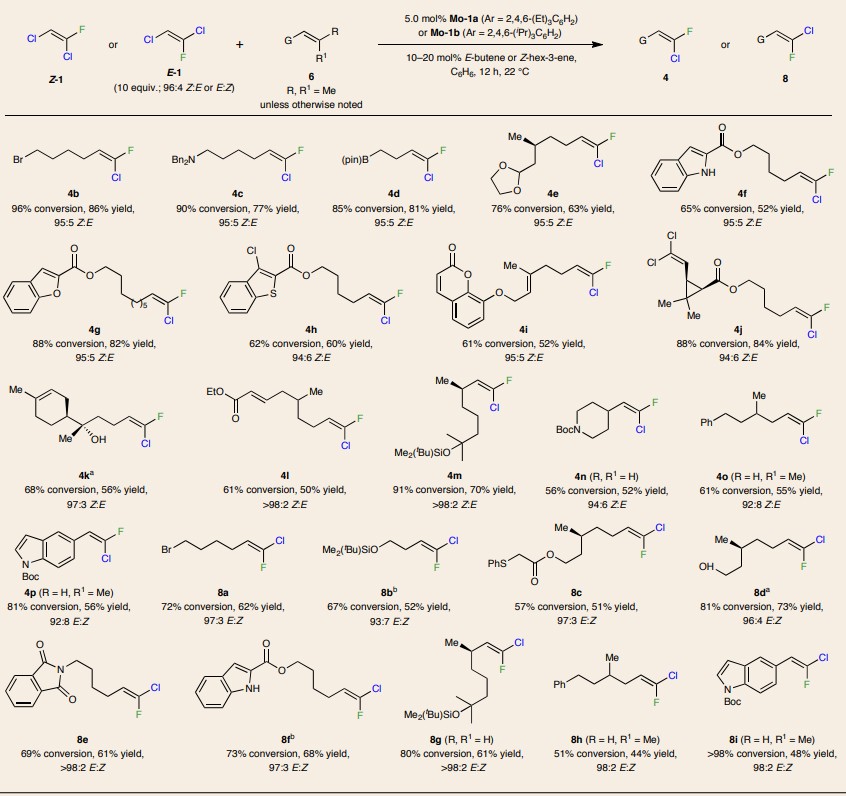
图4. 底物范围。图片来源:Nat. Chem.
在最优条件下,作者对三取代烯烃的底物范围进行了考察(图4),结果显示一系列官能团化的底物都能兼容该反应,如溴原子(4b)、叔胺(4c)、Bpin(4d)、缩醛(4e)、吲哚(4f)、苯并呋喃(4g)、苯并噻吩(4h)、内酯(4i)、环丙烷(4j)等,以高达86%的产率和>98:2 Z:E比得到了许多正烷基-Z-三取代的氯代、氟代烯烃。对于带有二取代烯酸酯的二烯底物(4l)而言,反应高化学选择性地在更富电子但位阻更大的三取代烯烃上进行。此外,带有α-支链(4m-n)和β-支链(4o)的底物也能实现这一转化,以中等至较好的转化率和优异的Z:E比得到所需产物。值得一提的是,该反应还能实现E-1(8a-i)的交叉复分解,以高E:Z比获得相应的E-三取代烯烃异构体,尽管转化率略低于相应的Z-烯烃,这可能是由于金属环丁烷中间体的空间张力增加所致。
鉴于二卤代烯烃有时太易挥发而不能以高产率分离,因此作者尝试在三取代烯基产物的C-Cl键上进行化学选择性转化,从而得到更易分离的类似化合物。例如,通过与烯基锌卤化物9发生钯催化的交叉偶联反应形成氟取代的烯酮10a-c(图5a)。类似地,作者还以良好的产率和优异的立体选择性制备了许多官能团化(如D、Bpin、Br、I、CF3、CN、酯基等)的三取代烯基氟化物(15-29,图6)。此外,该方法还能实现受阻烯烃11(甲硅烷基醚取代)的交叉复分解和随后的交叉偶联反应(图5b),以41%的总产率产生单一的烯烃异构体12a(Z:E >98:2)。类似地,作者还以40%的总产率和>98:2的Z:E比合成了相应的氟代烯丙基硅烷12b。如图5c所示,单取代末端烯烃13a或13b也能与Z-1和E-1实现交叉复分解反应,从而得到相应的产物4o和4q、8h和8j。值得注意的是,该反应还能实现13c的克级规模制备(图5d),以72%的产率和>98:2的Z:E比产生4m(1.1 g)。此外,将14(1.2 g)转化为4r(0.82 g,62%产率,95:5 Z:E)后,以80%的产率回收过量的Z-1(4.29 g,蒸馏后)并将其置于标准条件下进行反应,以60%的产率和95:5的Z:E比获得相应的产物4r(0.61 g)。
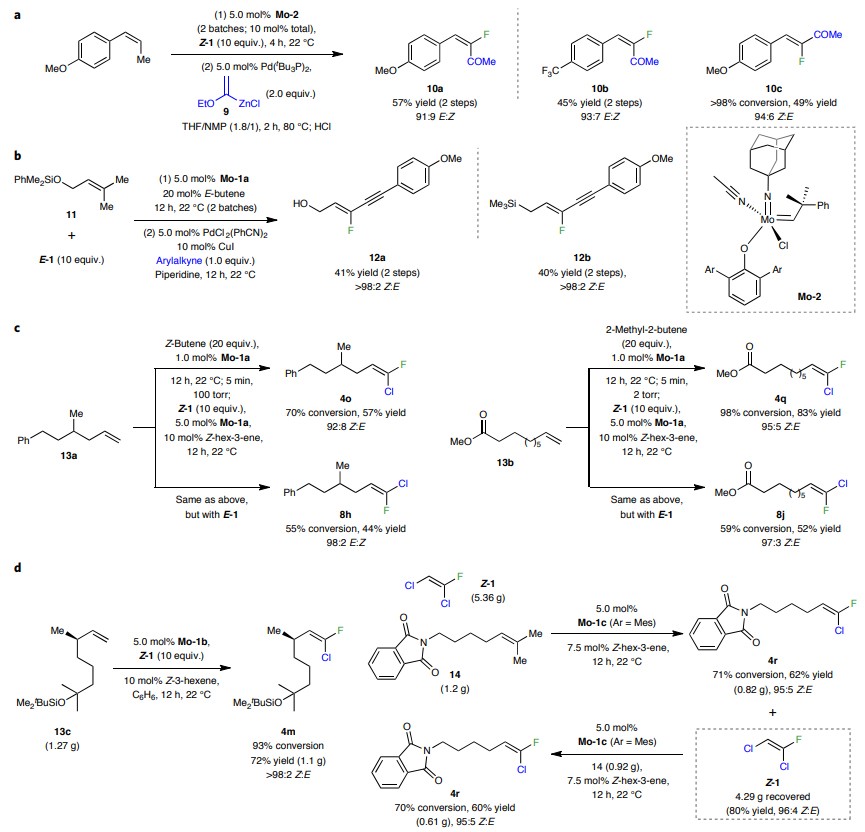
图5. 催化方法的普适性和高效性。图片来源:Nat. Chem.
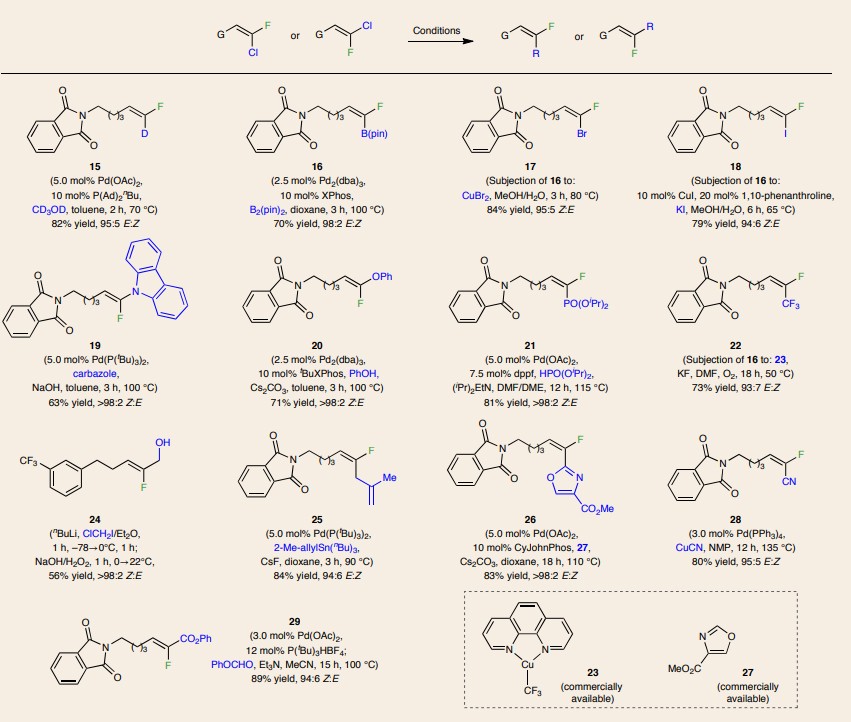
图6. 三取代烯基氟的衍生化。图片来源:Nat. Chem.
接下来,作者对二卤代烯烃产物进行了如下转化:1)位点选择性交叉偶联。含有末端二氯烯烃的E-三取代烯烃8k在Sonogashira条件下进行反应时(图7a),在靠近C-F的C-Cl 键上发生转化,以53%的分离产率得到氟取代的烯炔30a以及8%的氯取代烯炔30b(区域异构比(r.r.)为 87:13)。而在Negishi条件下与烯基锌氯化物9进行反应时则以相反的选择性得到单一的区域异构体31;2)位点特异性荧光标记。伯醇32与Z-1经原位保护、交叉复分解后,与炔基吡啶33进行交叉偶联,以81%的产率和>98:2的E:Z比得到E-氟取代的1,3-烯炔34,后者经两步转化便能以64%的总产率得到氟标记的hachijodine G 类似物(图7b);3)区域发散性荧光标记。烯烃35和Z-1发生交叉复分解反应后,与市售的正辛基溴化锌进行交叉偶联得到单一的立体异构体——E-三取代烯基氟38(图7d)。然而,从市售的三取代烯烃出发,经相同的反应顺序则产生Z-三取代烯基氟40。如果从三取代烯基氟化物38或40出发,则将位点特异性地获得任何一种油酰辅酶A的含氟有机类似物。
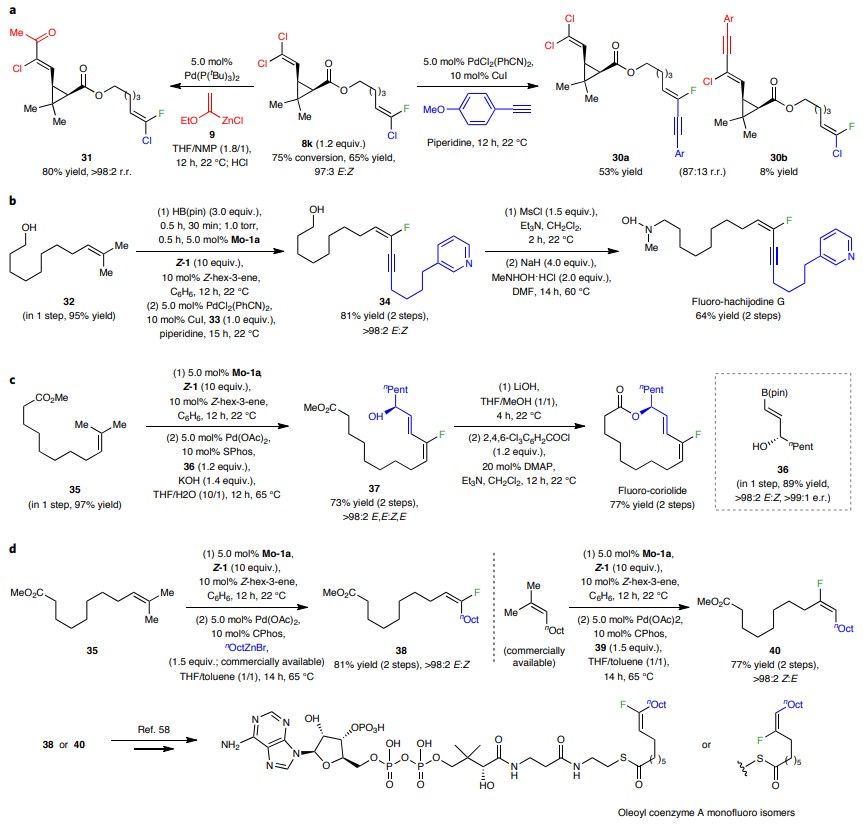
图7. 位点选择性衍生化。图片来源:Nat. Chem.
此外,该反应还能实现三取代烯基氟的非对映发散合成。如图8a所示,带有α-支链的单取代烯烃41与E-1和Z-1进行交叉复分解,然后与市售硼酸42进行交叉偶联,分别以65%和74%的总产率得到所需的Z-和E-异构体。此外,作者还从高烯丙基硅烷基醚43出发,经六步转化分别以27%和20%的总产率制备了E-或Z-酰胺键模拟物E-46和Z-46(图8b)。需要指出的是,作者还通过交叉复分解/交叉偶联序列将烯烃35转化为氟代烯基硼酸酯E-47和Z-47,而先前的方法则难以制备。最后,48通过交叉复分解合成氯代烯基氟化物E-49和Z-49,然后与含氟三取代烯基硼酸酯E-47和Z-47进行交叉偶联,便能合成二氟瘤胃酸甲酯的所有四种可能的立体异构体。
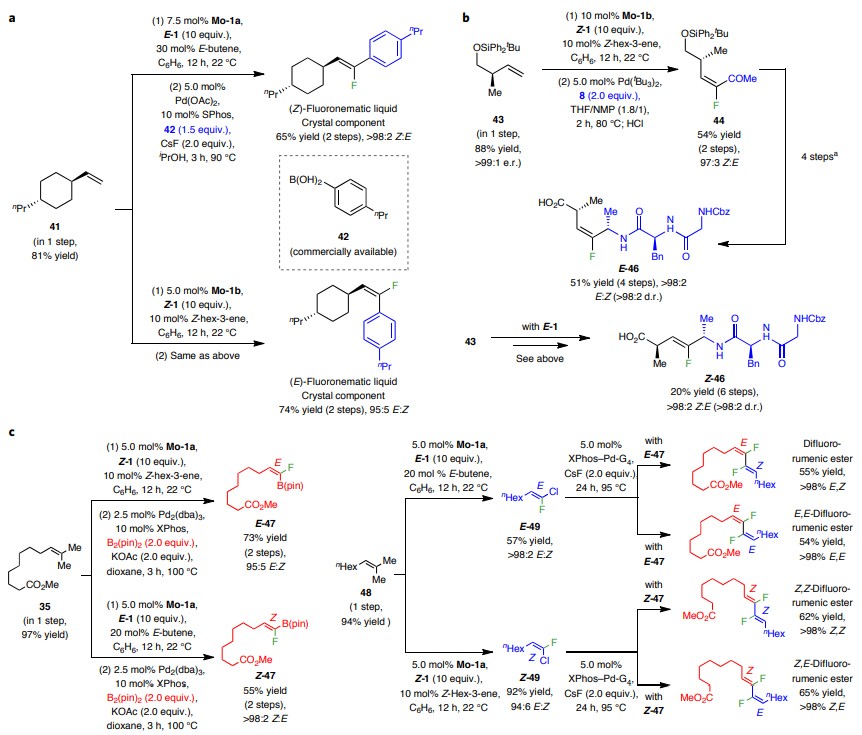
图8. 单氟和二氟标记的生物活性化合物的非对映发散合成。图片来源:Nat. Chem.
总结
Amir H. Hoveyda教授课题组开发了一种广谱且实用的方法来合成三取代烯基氟化物,为制备以前无法获得的化合物提供了直接途径。该策略能用于各种氟标记有机分子的可规模化、高效、位点特异性、非对映异构和/或区域发散合成。考虑到有机氟化合物的中心地位,本方法将在医学、农业化学和材料科学等领域产生显著的影响,特别是在氟标记的生物活性分子的制备和药物研发领域。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Stereodefined alkenes with a fluoro-chloro terminus as a uniquely enabling compound class
Qinghe Liu , Yucheng Mu , Tobias Koengeter , Richard R. Schrock, Amir H. Hoveyda
Nat. Chem., 2022, 14, 463–473, DOI: 10.1038/s41557-022-00893-5
导师介绍
Amir H. Hoveyda
https://www.x-mol.com/university/faculty/2140
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号