孔令义团队JACS:cGMP填充氧化损伤缺口G4复合物的NMR溶液结构解析
研究发现,基因组中富含鸟嘌呤(G)的DNA序列,在Hoogsteen氢键和钾或钠离子的稳定作用下,可以形成一种特殊的DNA二级结构,即DNA G-四链体(G4,图1)。G4在端粒和癌基因的启动子区域大量存在,它们调控着癌基因的复制、转录、翻译等过程,并参与维护基因组的稳定,对癌细胞的生长、增殖、侵袭和永生化等至关重要,是重要的癌症生物标志物。此外G4结构与双链DNA明显不同,可以被小分子化合物特异性结合和稳定,进而干扰癌基因的表达,最终杀灭癌细胞。因此,DNA G4被认为是最具潜力的抗癌药物研究新靶点之一。
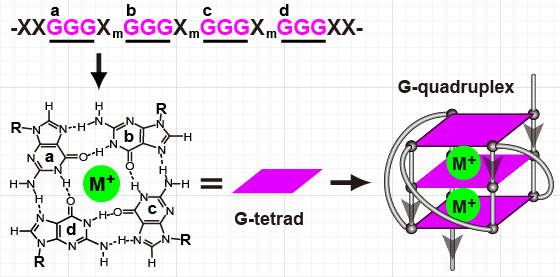
图1. DNA中G-四链体形成的示意图
核磁共振技术(NMR)在小分子化合物结构解析中应用广泛,其在生物大分子(如核酸、蛋白质等)结构解析中也发挥着重要作用。特别是在DNA G4的结构解析中,采用NMR技术能够解析接近人体生理溶液环境下的G4结构,相较于X-单晶衍射技术具有明显优势。
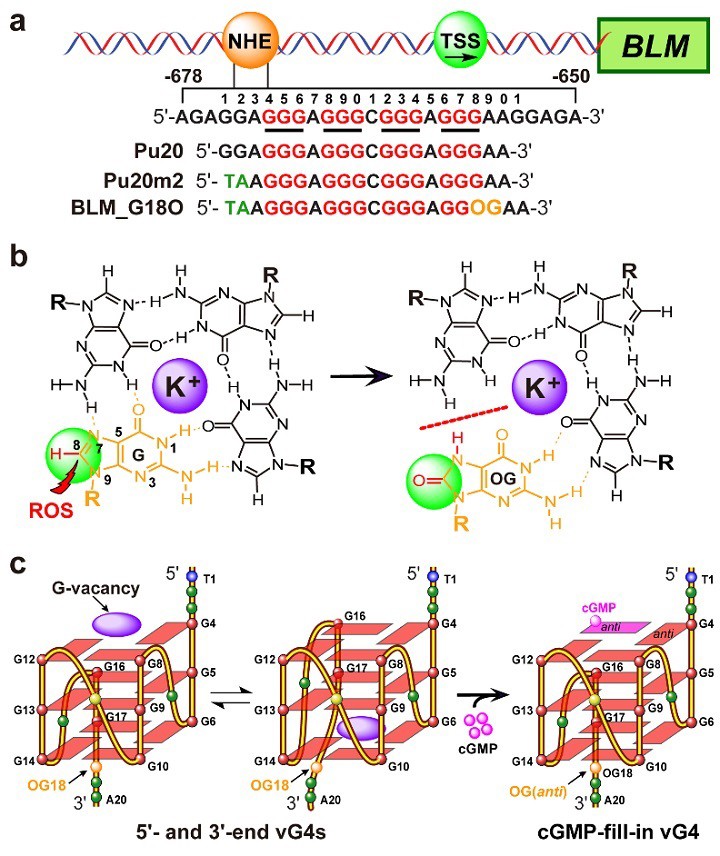
图2. ROS诱导缺口G4的形成及其被cGMP填充的示意图
近日,国际化学领域顶级期刊Journal of the American Chemical Society(JACS)在线发表了中国药科大学中药学院孔令义教授(点击查看介绍)团队的最新研究成果。该项工作中,研究者广泛采用NMR、ECD、MST和EMSA等实验,发现氧化损伤(ROS)可诱导人源BLM基因启动子序列形成缺口G4,且该缺口G4可以被cGMP等天然鸟嘌呤代谢物填充和稳定(图2)。进一步采集各种2D NMR 图谱(包括NOESY、COSY、HSQC等),结合分子动力学模拟,解析了cGMP与该缺口G4结合复合物的NMR溶液结构(图3)。此外,研究者分析了多种体内鸟嘌呤代谢物和抗病毒药物与该缺口G4的相互作用情况,为生命体的基因表达调控提出了新机制。本研究通过解析cGMP−BLM-vG4复合物的结构,为鸟嘌呤衍生物类抗癌药物设计提供了结构指导和新思路;同时也为靶向氧化损伤诱导的缺口G4新靶点的天然小分子抗癌药物研究提供了理论基础和新策略。
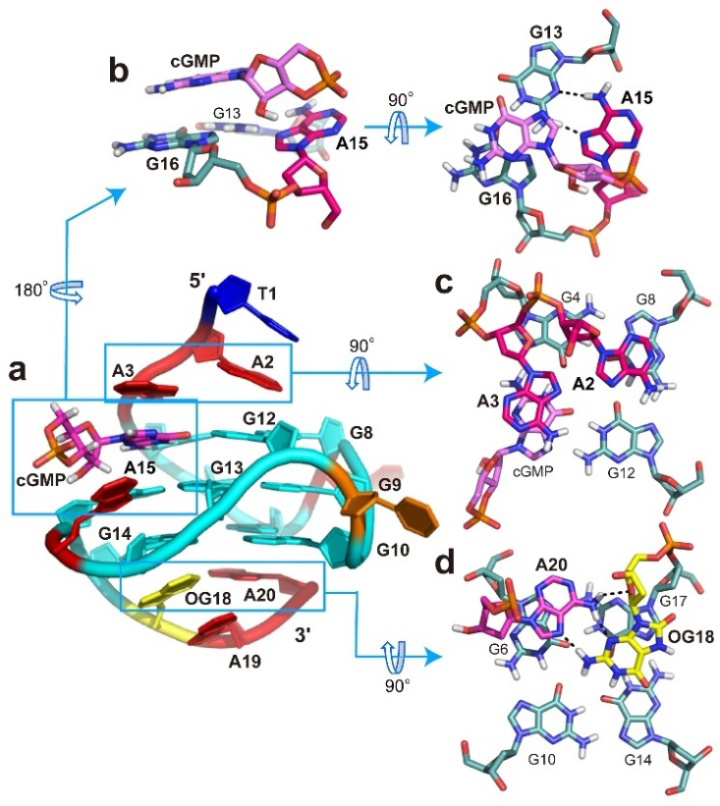
图3. NMR结构解析的cGMP−BLM-vG4复合物结构图(PDB ID: 7WGW)
王凯波特聘研究员和刘玉霜博士后为本文的共同第一作者,孔令义教授和美国普渡大学Danzhou Yang教授为本文的通讯作者,中国药科大学为本文第一通讯单位。
该项研究工作获得了国家自然科学基金、江苏省自然科学基金、中国药科大学高层次海外引进人才基金等资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Oxidative Damage Induces a Vacancy G-Quadruplex That Binds Guanine Metabolites: Solution Structure of a cGMP Fill-in Vacancy G-Quadruplex in the Oxidized BLM Gene Promoter
Kai-Bo Wang, Yushuang Liu, Yipu Li, Jonathan Dickerhoff, Jinzhu Li, Ming-Hua Yang, Danzhou Yang*, and Ling-Yi Kong*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c00435
导师介绍
孔令义
https://www.x-mol.com/university/faculty/210955
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
有机-金属杂化体对核酸四链体-双链杂化体的识别和溶液结构 2021-08-01
-
手持金刚钻,可揽“磁”器活:Science报道纳米级NMR技术重要突破 2017-07-25
-
你是我的眼:NMR在结构确证中的应用策略 2016-12-11
-
Interactions between heme and G-quadruplex DNA involve the oxygen of guanineJournal of Inorganic Biochemistry (IF 3.8) Pub Date : 2025-02-03 ,DOI:10.1016/j.jinorgbio.2025.112843Tapiwa Chiura, Minh N. Pham, Dana A. Baum, Piotr J. Mak
-
The Promoter Region of the Proto-Oncogene MST1R Contains the Main Features of G-Quadruplexes FormationInternational Journal of Molecular Sciences (IF 4.9) Pub Date : 2022-10-26 ,DOI:10.3390/ijms232112905Coralie Robert, Julien Marquevielle, Gilmar F. Salgado
-
Spectroscopic Characterization of Mitochondrial G-QuadruplexesInternational Journal of Molecular Sciences (IF 4.9) Pub Date : 2022-01-17 ,DOI:10.3390/ijms23020925Sara Illodo, Cibrán Pérez-González, Ramiro Barcia, Flor Rodríguez-Prieto, Wajih Al-Soufi, Mercedes Novo


































 京公网安备 11010802027423号
京公网安备 11010802027423号