Science:自由基偶联,瓣蕊花生物碱全合成变简单
主要分布于热带雨林的瓣蕊花属树木Galbulimima belgraveana和G. baccata,树皮中可提取出多种神经活性生物碱,这些生物碱基于哌啶与十氢化萘结构之间的连接性可进行化学分类(Galbulimima (GB) alkaloids,第I到IV类)(图1A-B)。此外,不同的连接性和取代模式还会带来多样性的生物学效应。目前,最简单的I类GB生物碱himbacine可拮抗毒蕈碱受体M1到M5。虽然I类生物碱会影响小鼠心动过缓和精神活性,但II类生物碱会导致心动过速和低血压,而III类生物碱(如:himgaline(1))则具有抗痉挛作用(IV类生物碱尚未测定)。除himbacine外,其它生物碱在树皮中含量很少,30多种同类生物碱混在一起,难以大量的分离纯化,后续也就无法进行充分的生物学研究,作用机理以及靶点都尚不清楚。这种情况下,合成化学家该出场了。一些开创性的工作实现了GB生物碱II类和III类的全合成(18到33步),但合成过程仍然具有巨大的挑战性。近年来,Movassaghi、Sarpong和Ma等人用简洁的策略(18-19步)分别合成了GB13,有助于合成化学家进一步探索II类和III类GB生物碱的全合成,但有关GB生物碱的通用合成策略却尚未被报道。
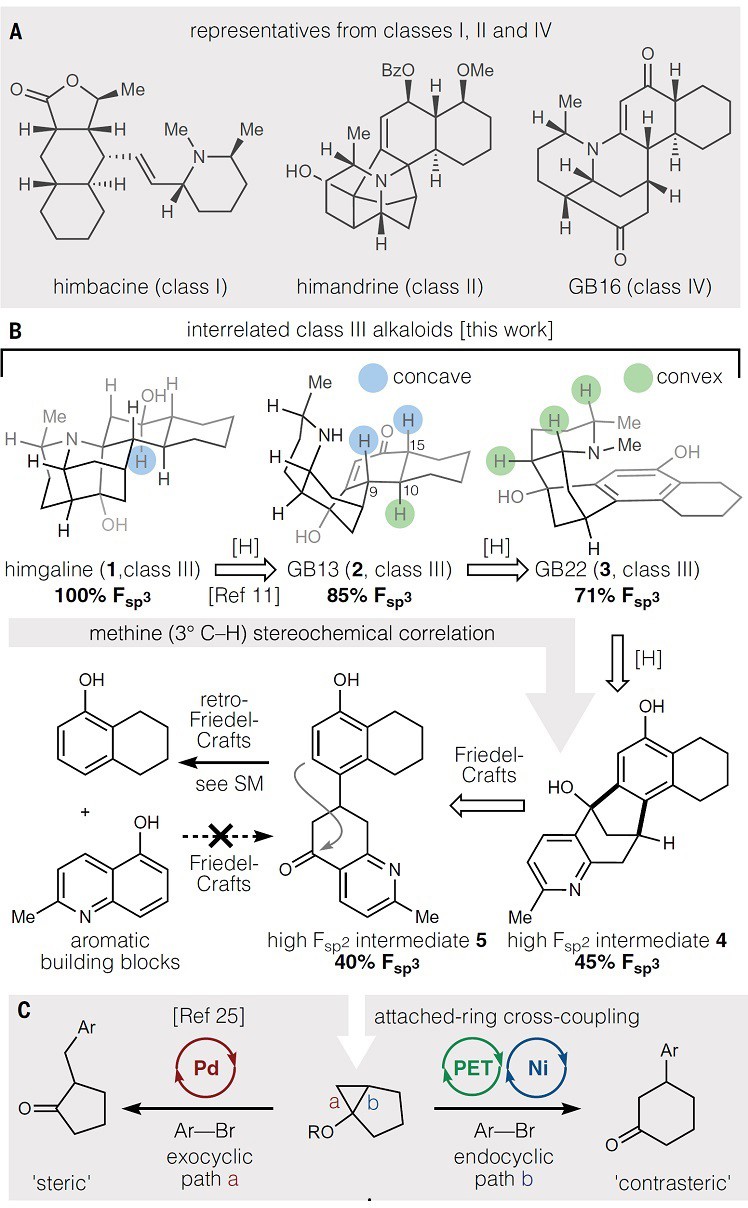
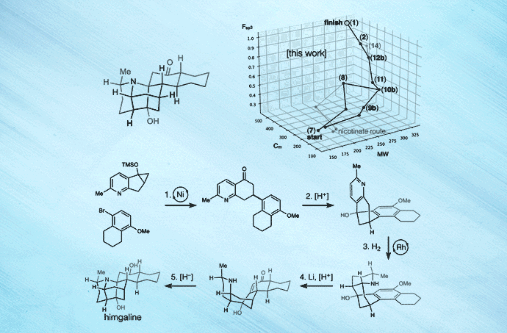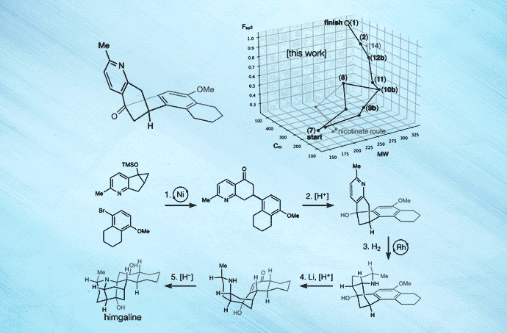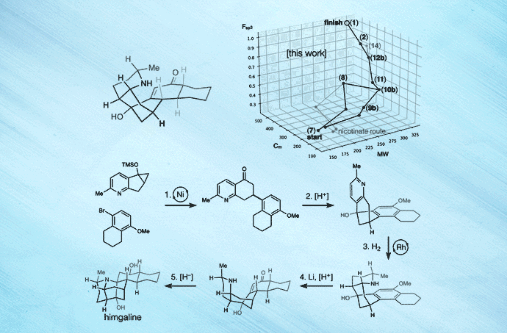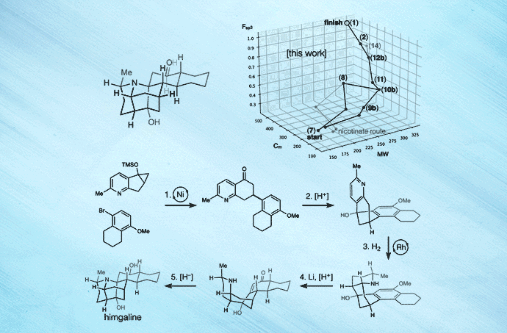
图1. 代表性的GB生物碱合成及分析 图片来源:Science
近日,美国斯克利普斯研究所(Scripps Research)的 Ryan A. Shenvi教授(点击查看介绍)课题组在Science 杂志上报道了选择性自由基交叉偶联和芳烃还原策略,成功地实现了GB22、GB13和himgaline的简明全合成。合成路线包含7至9步,比此前工作的19至31步大大缩减。而且,该策略具有通用性,有望用于GB生物碱的多样化合成。关于该策略,Shenvi教授解释道:“可以这么说,我们的方法有点类似于远途太空旅行——首先尝试到达目标恒星系,然后再去该恒星系内的特定行星,这就相对容易一些。”[1]
图片来源:Scripps Research [1]
首先,作者对GB22进行了相关的逆合成分析(图1B)。反应砌块经分子间酮芳基化得到中间体5,5经由Friedel-Crafts加成来构建桥环骨架中间体4,中间体4的吡啶骨架进行氢化即可完成GB22的分子内嵌入式连接环体系。实验证明,烯酮共轭加成不能构建5,这是因为四氢萘酚优先进行质子化和酸介导5的分解,阻碍了四氢萘酚与5-羟基-2-甲基喹啉的直接傅-克反应(图2A)。若以β-酮碳中心自由基取代含氧碳正离子,并结合芳基镍络合物构建5,就可以避免傅-克反应(图2C)。β-酮碳中心自由基的形成与光诱导甲氧基硅基环丙烷的开环有关。受光氧化还原-镍金属双催化交叉偶联平台的启发,作者设计了一个反应体系,其中光激发催化剂选择性地氧化裂解甲氧基硅基环丙烷,随后与芳基镍物种结合并经还原消除构建5(图2C)。与传统的过渡金属催化环丙醇和甲氧基硅基环丙醇芳基化反应相比(图1C,路径a),这种电子转移芳基化则提供了相反的区域选择性(图1C,路径b)。
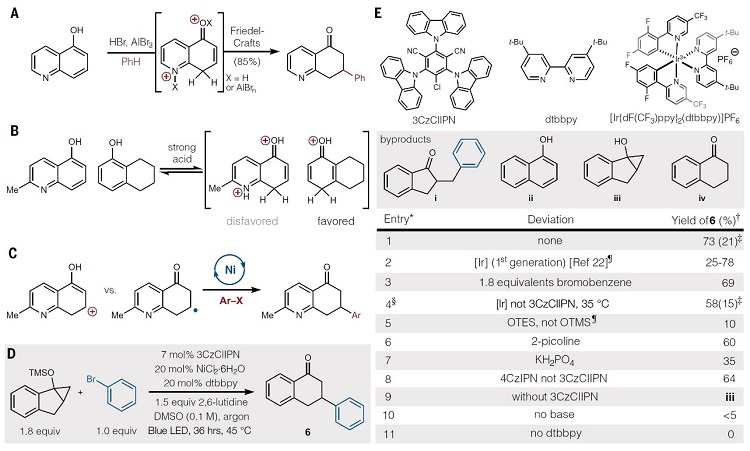
图2. 芳基化的筛选。图片来源:Science
紧接着,作者以TMS保护的环丙醇和芳基溴为模板底物对反应进行初步的探索,结果显示Doyle-MacMillan双催化剂 {Ir[dF(CF3)ppy]2(dtbbpy)}PF6和Ni(dtbbpy)Cl2体系表现不错(图2D)。环境温度也会影响产物6的收率,同时伴随副产物i-iv的生成。对反应装置、催化剂、溶剂以及碱的进一步筛选后获得最佳反应条件:即在有机光催化剂3CzClIPN、NiCl2•6H2O体系、DMSO为溶剂、2,6-二甲基吡啶为碱的条件下于45 ℃进行反应,能以73%的收率获得6。另外,此条件对一系列TMS保护环丙醇与卤代芳烃的反应均能耐受(图3A),并且芳烃上的吸电子基团或给电子基团均不影响偶联反应的效率,特别是杂环也可兼容该反应。需要指出的是,1-溴环己烯也能实现这一转化,尽管收率较低。
接下来,作者尝试合成GB22(图3B)。具体而言,从市售可得的酮7出发,经硅基烯醇醚化、Shi改良的Simmons-Smith环丙烷化两步得到甲硅烷氧基环丙烷8。此外,也可由2-氯- 6-甲基烟酸甲酯经Suzuki交叉偶联、Ti(i-OPr)4促进的烯烃与酯构建环丙醇、TMS保护三步合成8,以避免Simmons-Smith环丙烷化面临的难纯化问题。同时,1-萘酚经由NBS溴代、羟基保护完成溴代芳烃9a或9b的合成。接着,8和9经光氧化还原-镍金属催化的交叉偶联反应构建高比例芳族结构单元(高Fsp2)连接的环中间体10a/b,后者经Friedel-Crafts芳基化即可构建桥环骨架中间体4。实验证明:诱导效应不利于酚醚的间位反应,强Brønsted酸的初始筛选仅获得产物4,并且三氟甲磺酸使得10a/b竞争性质子化并发生逆-Friedel-Crafts芳基化。经过一系列筛选,作者发现将二乙基氯化铝添加到HFIP中可实现4(收率:52%)和11(收率:86%)的高效构建,其环化机理可能涉及HFIP的酸化、铝桥连接的强双氢键供体形成或强Lewis酸性络合物的形成等。然后,4和11经Rh/Al2O3促进的立体选择性氢化得到12a/b,其中12a经N-甲基化可直接合成GB22(3),而12b则需要通过BBr3去甲基化获得12a后再经N-甲基化两步实现GB22(3)的全合成。
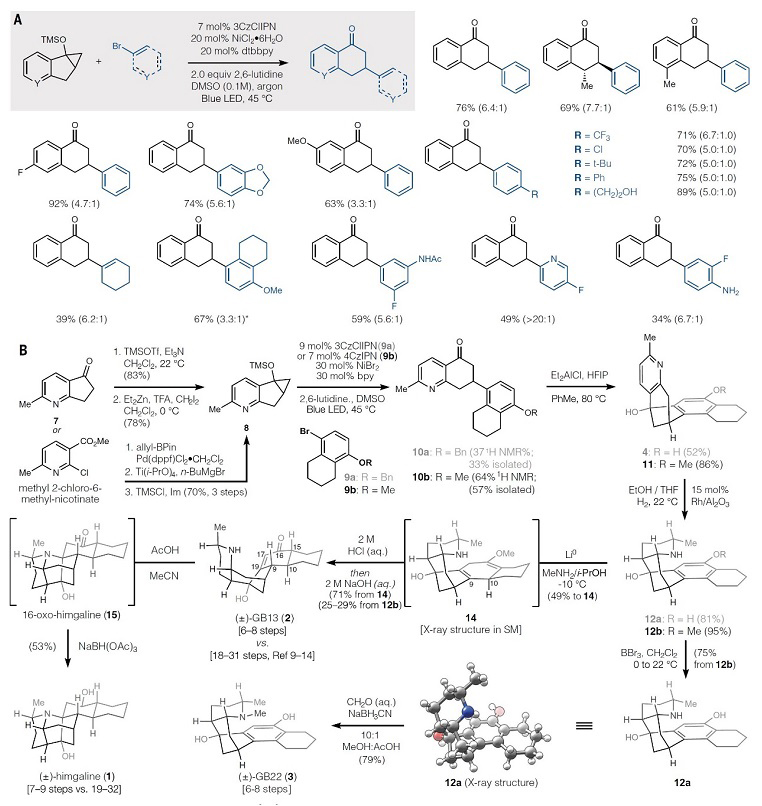
图3. 合成研究。图片来源:Science
随后,作者用酚甲醚结构12b来探讨哌啶环初期控制十氢萘酮立体化学。12b经Birch还原和电化学还原均不成功,而Benkeser还原则能构建单一的异构体14;质子源和金属对该步反应至关重要,MeOH、EtOH 和 t-BuOH以及Na0并不能促进还原,有意思的是,他们尝试了近期Koide报道的改进Birch还原反应(Science, 2021, 374, 741–746,点击阅读详细),取得很好的效果且操作更简便。另外,14的凸面C10位分子间质子化导致单一的非对映异构体和区域异构体占主导地位,尽管哌啶N-H键分子内质子转移到C9位的可能性很大。同时,14经酸化水解、碱化两步便能以71%的收率合成GB13(2),其余各次甲基立体中心均采用所需的相对构型,仅有一个次甲基(C10)将其氢原子定位到凸面,而两个新的立体中心(C9 和 C15)则来自向内投射氢的潜手性平面碳。因GB13特殊的立体化学,它在酸催化下自发形成热力学偏好的环状互变异构体16-oxo-himgaline(15),再经还原便可完成himgaline(1)的全合成。此外,因14的分离和起始材料的不同,GB13和himgaline的合成步骤也不同(图4),如要获得高纯度的GB13,其14可在酸性水解前经柱色谱纯化去除副产物,而himgaline纯化并非必需。

图4. 化学空间合成研究。图片来源:Science
最后,作者以化学空间漫步(a walk through chemical space)的形式对himgaline合成进行了可视化分析,认为GB生物碱结构的化学空间可更好地参数化,以便进行相关生物学靶点及活性研究。他们还对一些反应进行了放大,比如10b的交叉偶联(1.3 g)、11的Friedel- Crafts反应(1 g)和12b的氢化(834 mg),用于多样化合成和靶点识别。鉴于25种II类和III类GB生物碱之间的结构相似性,该方法很有希望成为一种通用的GB生物碱全合成方法,可支持后续的生物学活性、作用机制、临床转化等研究。
总结
Shenvi教授课题组用选择性自由基交叉偶联和芳烃还原策略成功地实现了GB生物碱GB22、GB13 和himgaline 的简明全合成,合成路线大大缩短。该项工作为GB生物碱的合成提供了通用策略,有助于对这些具有神经活性的化合物的进一步生物学研究。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Concise syntheses of GB22, GB13, and himgaline by cross-coupling and complete reduction
Eleanor M. Landwehr, Meghan A. Baker, Takuya Oguma, Hannah E. Burdge, Takahiro Kawajiri, Ryan A. Shenvi
Science, 2022, 375, 1270-1274, DOI: 10.1126/science.abn8343
导师介绍
Ryan A. Shenvi
https://www.x-mol.com/university/faculty/691
参考资料:
1. Scripps Research chemists find a quick way to synthesize novel neuroactive compounds found in rainforest tree
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号