上科大杨晓瑜课题组Angew. Chem:芳胺不对称C-H胺化构建平面手性大环
平面手性环芳烷(cyclophane),是一种特殊的具有平面手性的大环化合物,其在天然产物、不对称催化、主客体化学和材料科学中均具有广泛的应用。该类化合物一般由一个取代的芳环以及一根大环侧链组成,该类化合物的平面手性来源于大环的侧链阻碍了取代芳环的自由翻转,因此可以被看作是阻旋异构体(atropisomer)的一种。
近年来,平面手性大环的不对称催化合成吸引了合成化学家的研究兴趣,已有三种不同的策略被应用于其不对称催化合成之中(图1)。第一种策略是通过构建取代的芳环实现平面手性环芳烷的不对称合成,其中典型的代表是Tanaka课题组发展的利用三炔的不对称[2+2+2]环加成反应来合成平面手性环芳烷(Angew. Chem. Int. Ed. 2013, 52, 5617)。第二种策略是利用芳环的不对称取代反应引入大位阻基团来阻碍芳环的旋转。第三种策略是直接的不对称大环化反应,最近Collins课题组利用酶催化的二羧酸和二醇的直接大环化反应实现了一系列平面手性大环的不对称合成(Science 2020, 367, 917,点击阅读详细)。尽管该领域近年来取得了显著的进展,但是其中很多方法仍然受限于反应的低产率、不能令人满意的立体选择性以及使用当量的手性促进剂等,因此发展高产率、高对映选择性的不对称催化构建平面手性大环的方法仍是非常必要的。
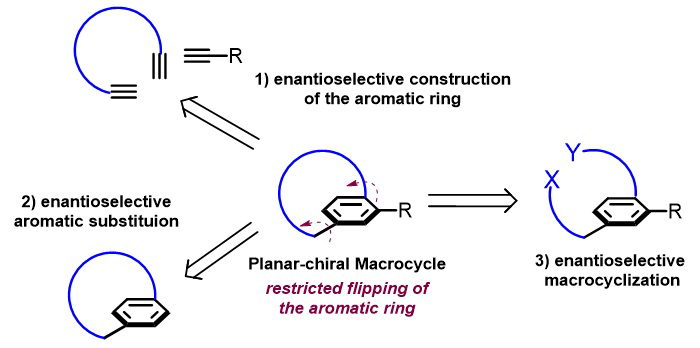
图1. 平面手性大环不对称催化构建策略
近期,上海科技大学杨晓瑜(点击查看介绍)课题组利用手性磷酸催化芳胺与偶氮二甲酸酯的不对称胺化反应,相继实现了轴手性联芳基二胺(BINAM)和联芳基氨基醇(NOBIN)的动力学拆分(Angew. Chem. Int. Ed. 2020, 59, 23598)、2,2-二取代氢化喹啉的动力学拆分(Angew. Chem. Int. Ed. 2021, 60, 5268)以及α-叔炔丙胺的动力学拆分(ACS Catal. 2021, 11, 8443)。近期,该课题组进一步利用该反应实现了具有平面手性的对环芳烷类手性大环的不对称合成。
作者利用手性磷酸TRIP催化非手性的大环底物1与偶氮二甲酸酯2的不对称对位C-H胺化反应,通过引入大位阻的取代肼基阻碍苯环的自由翻转,从而成功实现平面手性大环3的不对称合成(图2)。作者通过对底物适用性的研究发现,当使用-NH2作为活化基团时,侧链为12、13、14个原子时(3a-3e),平面手性大环都能以高对映选择性成功构建。而当侧链长度延长至15元时,所得大环产物没有平面手性(3f);这是由于随着环的增大,它已经不能有效限制苯环的翻转。而当使用位阻更大的-NHBn作为活化基团时,大环的侧链可以进一步延长至15、16、17、18、19个原子,且能兼容各种官能团(3g-3m);而当侧链进一步延长到20个原子时,所得的产物为消旋的,这说明此时侧链的长度也已无法阻碍苯环的旋转(3n)。理论上,当侧链足够短时,单取代的对环芳烷也可以具有平面大环手性。作者发现具有12元侧链的N-Bn取代底物(1o)在手性HPLC上表现出一个包峰,同时存在两个小肩峰,这说明该化合物存在平面手性,但其在室温下的消旋化能垒较低。对于这一底物进行反应,同样能以高产率和高对映选择性得到平面手性大环3o,且在反应过程中未观察到动力学拆分的现象。
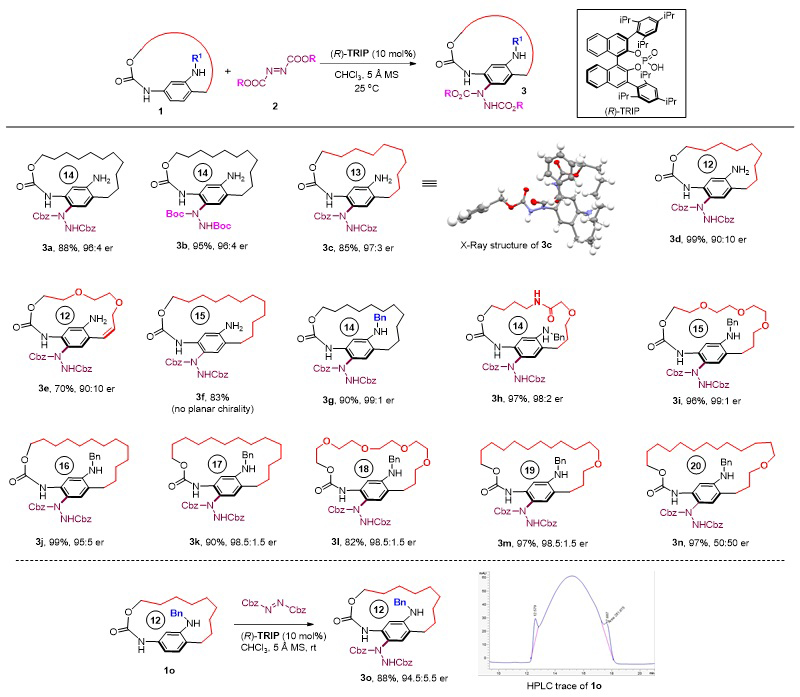
图2. 芳胺不对称亲电C-H胺化构建平面手性大环
作者也进行了一些控制实验来研究反应立体选择性的来源。作者发现当使用-NH2和-NHMe作为活化基团时,反应都能取代优异的对映选择性;而当使用-NMe2作为活化基团时,反应的活性和立体选择性都有明显的下降(3q),这说明底物1-位氨基上的NH很可能可以通过与手性磷酸形成氢键而活化底物。作者将底物5-位的氨基甲酸酯结构换成酰胺时,反应立体选择性有所下降(3r);而将5-位的连接变成苄酯时,反应仍能以较高的立体选择性给出平面手性大环产物(3s)。这一结果说明,该反应底物中苯环5-位的氨基并不是必须的,该反应可以拓展到更广阔的底物类型,但5-位的氨基甲酸酯可能可以有助于反应立体选择性的控制。
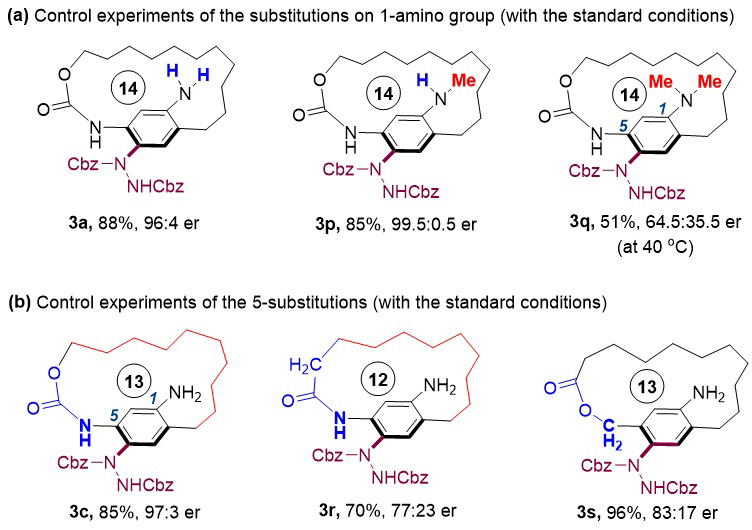
图3. 控制实验
和上海有机所薛小松(点击查看介绍)课题组的计算化学合作研究表明,该反应的确是通过手性磷酸与底物1-位NH2形成氢键而促进反应的,而手性磷酸与底物5-位氨基甲酸酯形成氢键的过渡态是能量不利的(图4a)。该反应的途径是历经亲电加成和去质子芳构化过程,反应的决速步是亲电加成步骤。对于反应立体选择性的起源,作者也进行了计算研究,结果表明在不利的过渡态中大环侧链的亚甲基与手性磷酸(TRIP)3-位三异丙基苯基中的异丙基存在明显的位阻排斥作用,两个手性过渡态的能量差值达到3.6 kcal/mol,这与实验观察到的立体选择性是吻合的(图4b)。同时,作者也对3-位无取代的简化手性磷酸进行了计算,发现两个手性过渡态的能量差值仅为0.6 kcal/mol,这与实验中发现减小手性磷酸催化剂3-位取代基位阻作用会导致其反应立体选择性急剧下降的现象也是吻合的。
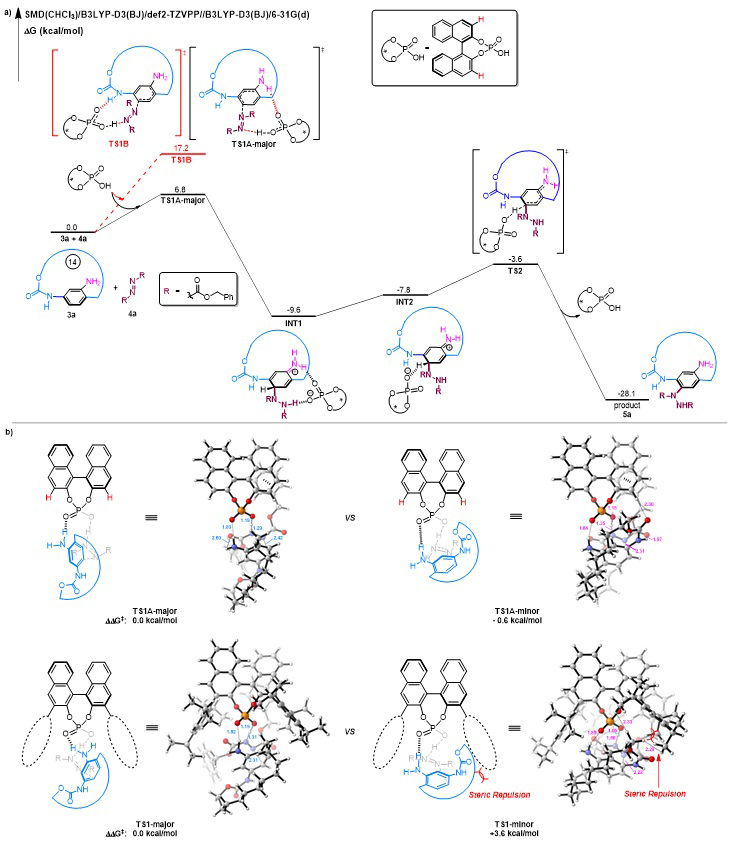
图4. 反应机理计算研究
作者也对手性产物的转化和应用进行了初步的研究(图5)。作者通过N-Ts保护和氢化还原,以对映体纯度保持地将平面手性大环3a转化成4a。而这两个平面大环化合物都可以作为一种新型手性一级胺催化剂,作者成功将这两种催化剂应用于α-取代醛5a的不对称胺化反应中,并都取得了令人满意的立体选择性。
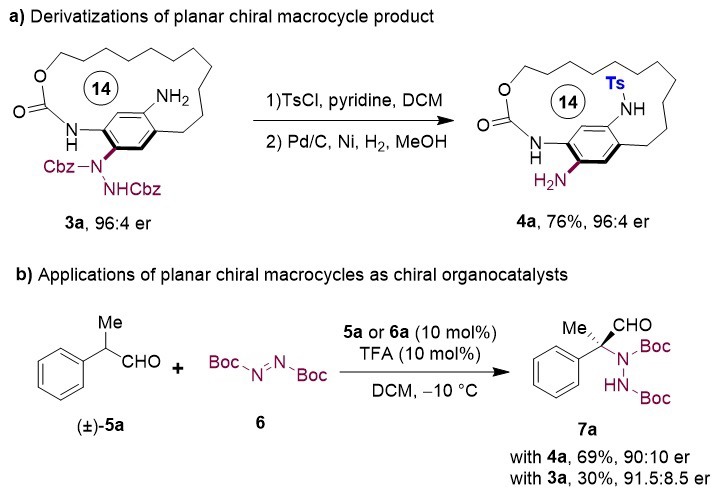
图5. 手性产物衍生化及其应用
综上所述,杨晓瑜课题组利用手性磷酸催化芳胺不对称亲电C-H胺化反应实现了一系列平面手性大环分子的不对称合成。该方法具有产率高、立体选择性优异、底物官能团兼容性好的优点,可以构建一系列从16元环至23元环大小不等的平面手性大环分子。控制实验和计算机理研究揭示该反应的机理以及立体选择性的起源。初步将该平面手性大环产物作为新型手性胺催化剂证明了该反应的潜在应用价值。
该研究成果近期发表在国际学术期刊Angew. Chem. Int. Ed.(《德国应用化学》)上。杨晓瑜课题组2022届博士研究生王东磊和南开大学邵英博为本文共同第一作者,上海科技大学为本论文第一完成单位,薛小松研究员和杨晓瑜教授为本文通讯作者。以上工作都得到国家自然科学基金委和上海科技大学科研启动资金的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Synthesis of Planar-Chiral Macrocycles through Asymmetric Electrophilic Aromatic Amination
Donglei Wang, Ying-Bo Shao, Yunrong Chen, Xiao-Song Xue*, and Xiaoyu Yang*
Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202201064
导师介绍
杨晓瑜
https://www.x-mol.com/groups/Yang_Xiaoyu
薛小松
https://www.x-mol.com/groups/xue_xiaosong
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号