清华大学罗三中课题组Science:基于烯胺光化学E/Z异构化的去消旋化
羰基化合物作为自然界中广泛存在的重要化工原料之一,其转化一直以来都备受关注,特别是羰基的不对称转化还可以提供药物研发所需的手性纯产物。如图1A所示,这些反应大多是通过烯醇(酸酯)或烯胺中间体来构建C-C/C-X键,并且产物的立体选择性是由中间体的几何形状和面选择性决定的。事实上,对于手性纯α-叔羰基化合物的构建而言,最理想、最直接的合成方法莫过于催化去消旋化,但是该过程需要克服以下三大挑战:1)去消旋化本质上是熵减过程;2)该过程与微观可逆性原理相悖;3)α-叔羰基化合物很容易通过不希望的替代途径消旋化。Bach课题组、Knowles和Miller课题组分别利用光介导的能量转移或电子转移与手性催化剂的协同催化实现了联烯或环脲的对映选择性去消旋化(图1B),但发展一种高效的去消旋化策略仍是手性合成的一个挑战性难题。
2011年,罗三中教授课题组利用手性伯胺催化体系,发展了不对称烯胺质子化反应(Angew. Chem. Int. Ed., 2011, 50, 11451–11455)。该工作中,他们实现了对质子的立体选择性迁移调控,而该体系演化的终极目标即是简单醛酮的去消旋化。[1] 近日,清华大学化学系罗三中教授(点击查看介绍)课题组将胺催化与可见光催化相结合,利用光化学介导的E/Z异构化策略,成功地实现了α-支链醛的高选择性去消旋化反应(图1C)。该反应不仅条件温和、底物范围广、官能团耐受性好,而且还能合成一系列手性非甾体抗炎药物。相关成果于近日发表在Science 上,清华大学化学系2017级博士生黄谋新和张龙副研究员为共同第一作者,罗三中教授为通讯作者,2019级本科生潘畑润参与了实验工作。[1]
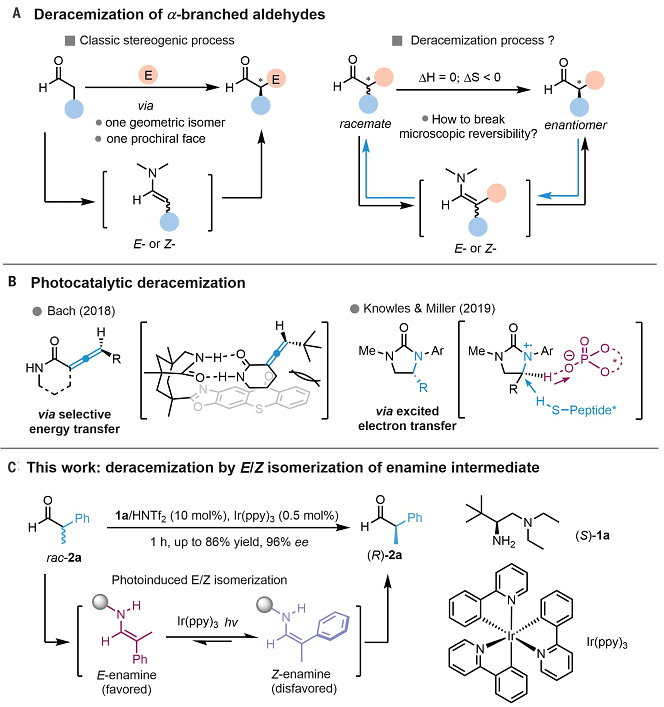
图1. 去消旋化策略。图片来源:Science
首先,作者选择2-苯基丙醛2a为模板底物对反应条件进行优化(图2),结果显示Ir(ppy)3的效果最好,同时添加少量弱酸(如苯甲酸)可显著提高对映选择性。当2a在Ir(ppy)3、苯甲酸和(S)-1a/HNTf2的条件下进行反应时,仅需1 h就能以77%(分离产率:73%)的产率、94%的ee值得到(R)-2a,并且还能以5 mmol规模进行反应。对照实验表明胺催化剂、光催化剂和光照都是必不可少的。另外,作者还考察了光学纯底物(R)-2a和(S)-2a的反应效果,结果显示(R)-和(S)-2a均导致(R)-选择性并且具有相当的对映选择性。相反,这些底物在没有光照的条件下则观察到消旋化,这表明光为去消旋化反应提供了主要驱动力。
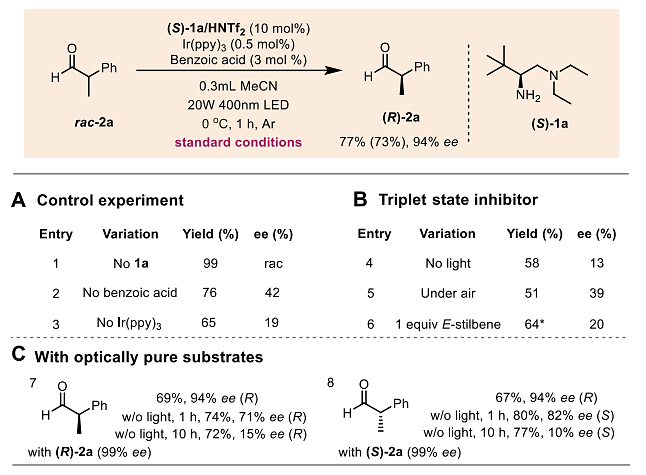
图2. 反应条件优化。图片来源:Science
接下来,作者考察了这种去消旋化反应的底物范围(图3A),结果显示芳环上带有烷基(2a-d)、芳基(2e)、缺电子基团(2f-m)和供电子基团(2n-s)的2-芳基丙醛以及α-杂芳基醛(如噻吩(2af)、二苯并呋喃(2ag)和吡啶(2ah))均能兼容该反应,并以中等至较好的产率和高对映选择性得到所需产物。此外,该反应还能耐受多种官能团,例如:卤素原子(2f-h、2j、2l-2m)、三氟甲基(2i)、酯基(2k)、烷氧基(2n、2q、2s)、芳氧基(2o、2p)、亚甲基二氧基(2r)、甲硫基(2t)、二甲氨基(2u)、酰胺(2ab)、炔基(2ac)等。有趣的是,当底物中同时含有醛羰基和酮羰基时,去消旋化优先发生在醛羰基的α-碳上,而酮羰基则保持不变(2v)。类似地,当底物中含有不同的手性中心时(如类固醇(2ad)、氨基酸(2ae)),去消旋化也能有效地进行。遗憾的是,扩大芳环或增加支链大小则会导致产物(2w-aa)的对映选择性略有降低。其次,作者还研究了α-支链酮(2aj和2ak)的去消旋化,但都以失败告终。最后,作者对产物(R)-2进行了衍生化(如氧化、还原、缩合),获得了一系列非甾体抗炎药(5d、5m、5p、5v)、醇(3p)和亚胺(4p),并且对映选择性没有损失(图3B)。
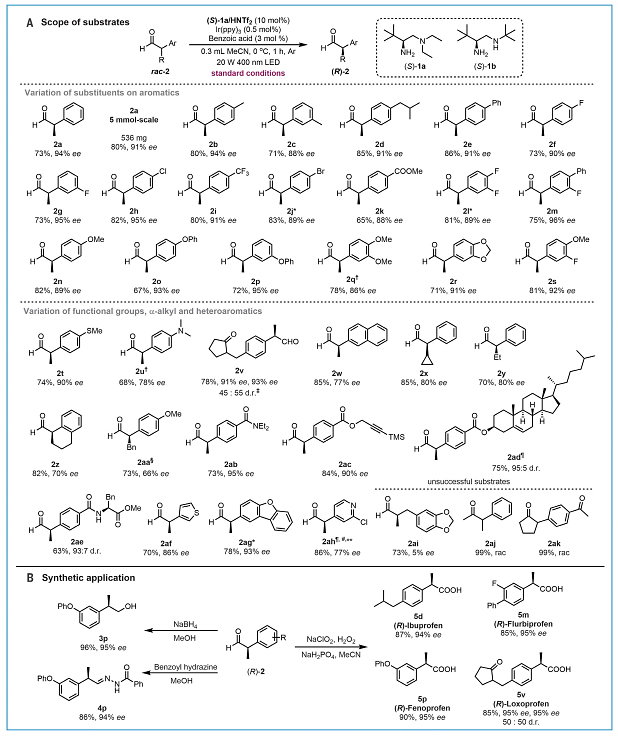
图3. 底物范围和合成应用。图片来源:Science
在去消旋化过程中,光化学微扰(photochemical perturbation)可能通过电子转移(随后是氢转移)或能量转移诱导的异构化进行。但是,该反应中似乎不是通过电子转移进行,这是因为反应所获得的对映选择性似乎与激发态的氧化还原电位无关,而是与三重态能量(ET)相关,正如在不同光催化剂筛选中所揭示的那样。事实上,当使用光催化剂的三重态能量在56-59 kcal/mol时,反应能获得高对映选择性,这与烯胺中间体的三重态能量(54.2 kcal/mol)相一致。此外,当向反应中添加典型的三重态淬灭剂(E-二苯乙烯或氧气)时,去消旋化被显著地抑制,这进一步表明该反应是通过能量转移机制进行的。
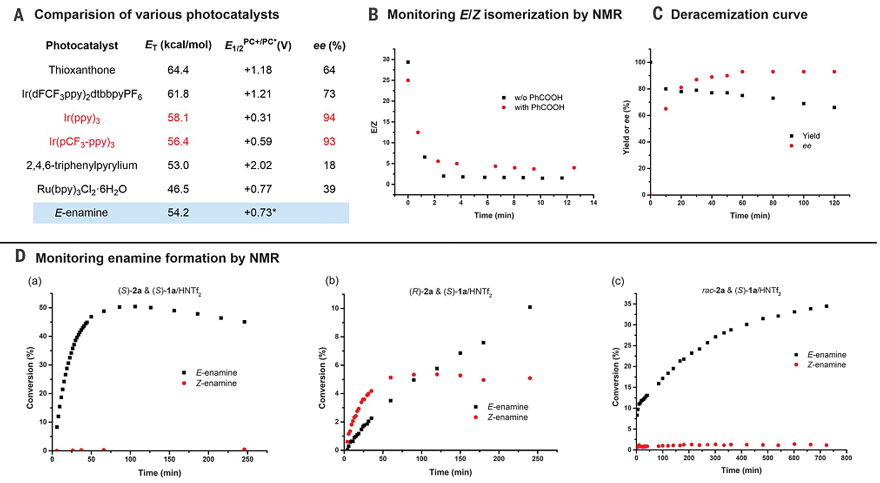
图4. 机理研究。图片来源:Science
随后,作者还进行了化学计量实验并通过核磁共振(NMR)谱来监测烯胺的形成。在(S)-1a/HNTf2的存在下,(S)-2a选择性地形成E-烯胺,并在约50%的转化率下达到平衡(图4D,a);而(R)-2a优先产生Z-烯胺,其在相当低的转化率(~5%)下达到平衡(图4D,b),之后观察到E-烯胺的形成;rac-2a则显示出与(S)-2a相似的动力学曲线(图4D,c),其中E-烯胺为主要异构体(E/Z = 30:1,在约35%的转化率下达到平衡)。这些结果表明(S)-2a和(S)-1a在立体化学上相互匹配,它们的偶联导致E-烯胺的形成,这在热力学和动力学上都是有利的。此外,作者还通过原位NMR实验研究了烯胺的异构化。通过光纤将405 nm激光束引至NMR光谱仪内部的预平衡反应混合物中,发现E-烯胺迅速异构化为Z-烯胺,并在3 min内达到光稳定状态,E/Z-烯胺比维持在1.7:1或4:1,这取决于酸添加剂的存在(图4B)。淬灭研究证实,激发态的光催化剂可以被烯胺选择性地淬灭。与此同时,作者还跟踪了2a去消旋化的反应进程,结果显示光动力平衡在1 h内建立并具有94%的ee值(图4C)。其它底物(如2f、2h、2w、2y和 2aa)也观察到类似的情况,延长反应时间后对映选择性没有改变,但关闭光源会立即消旋,这表明去消旋化是由光化学介导的烯胺异构化驱动的。
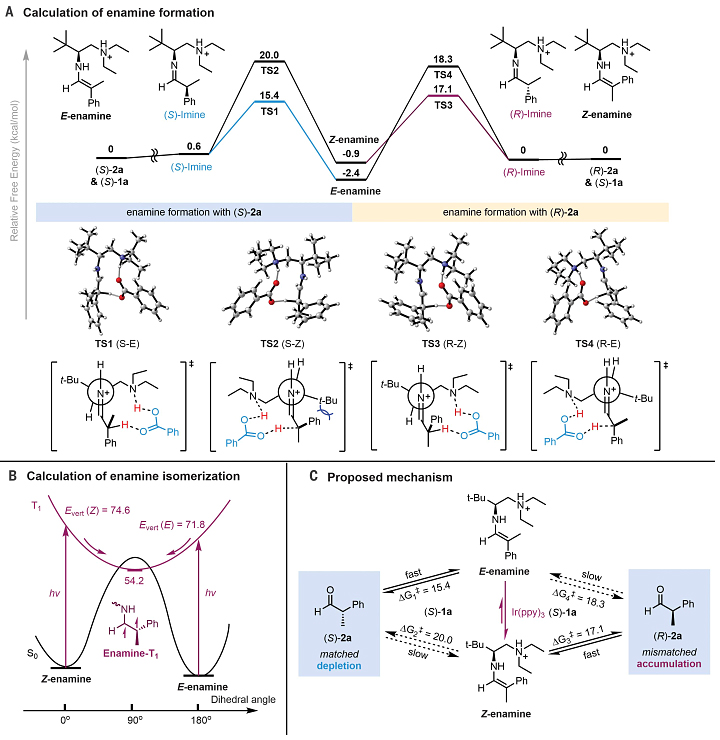
图5. DFT计算及可能的机理。图片来源:Science
最后,作者还进行了DFT计算。如图5A所示,(S)-2a会选择性地形成E-烯胺(TS1 vs TS2),而(R)-2a则部分形成Z-烯胺(TS3 vs TS4),这些结果与实验观察到的烯胺形成动力学曲线完全一致(图4D)。根据微观可逆性原理,E-烯胺通过TS1和TS4进行质子化产生(S)-2a,而Z-烯胺则通过TS2和TS3进行并产生(R)-2a。此外,E/Z烯胺的垂直激发能(S0→T1)分别为71.8 kcal/mol和74.6 kcal/mol,这意味着更有利于E-烯胺的激发(图5B)。在此基础上,作者提出了可能的反应机理(图5C):在基态下,立体化学匹配的对映异构体优先形成E-烯胺,后者通过光催化的能量转移不断地异构化为Z-烯胺。随后,Z-烯胺的面选择性质子化提供不匹配的对映异构体(R)-2a。也就是说,构型匹配的对映异构体(S)-2a不断被消耗,构型不匹配的对映异构体(R)-2a不断富集,从而实现了去消旋化。在这个过程中,手性伯胺催化烯胺质子化的立体专一性也是产物获得高对映选择性的关键决定因素。
总结
罗三中教授课题组报道了一种光化学介导的E/Z异构化策略,通过使用简单的胺催化剂和现成的光敏剂,将小分子催化和光催化珠联璧合,成功地实现了α-支链醛的去消旋化,可将多种外消旋α-支链醛高选择性地转化为任一对映体。快速光动力E/Z异构化和高度立体特异性的亚胺/烯胺互变异构是该反应的两个关键因素。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Deracemization through photochemical E/Z isomerization of enamines
Mouxin Huang, Long Zhang, Tianrun Pan, Sanzhong Luo
Science, 2022, 375, 869-874, DOI: 10.1126/science.abl4922
1. 化学系罗三中团队创新开发手性分子合成新方法
https://www.chem.tsinghua.edu.cn/info/1088/3070.htm
导师介绍
罗三中
https://www.x-mol.com/university/faculty/60337
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号