云南大学张洪彬团队:Sarpagine-Ajmaline-Koumine型吲哚生物碱的集群式全合成
近日,云南大学张洪彬教授团队利用Mannich型串联环化、二碘化钐介导的高立体选择性自由基环化和碘鎓诱导的吲哚亲电环化等反应为关键步骤高效地完成了14个高度复杂的Sarpagine-Ajmaline-Koumine型吲哚生物碱的集群式全合成,其中8个分子为首次全合成。相关成果发表在国际高水平期刊Nature Communications 上,论文第一作者为陈文副研究员,张洪彬教授和羊晓东教授为通讯作者。
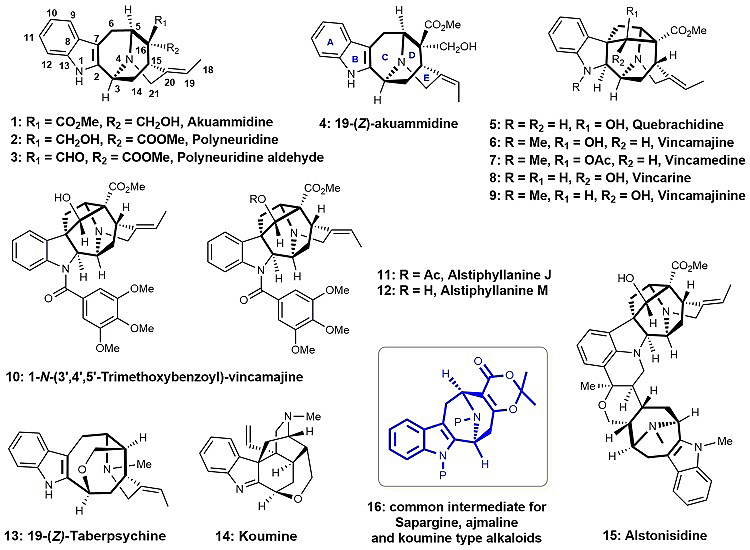
图1. 一些代表性的Sarpagine-Ajmaline-Koumine型吲哚生物碱
Sarpagine型吲哚生物碱具有一个9-氮杂双环[3.3.1]壬烷骨架的多环体系(图1)。它们是更为复杂的Ajamaline型和Koumine型笼状吲哚生物碱的生物合成前体。这些生源相关的生物碱主要是分离自具有药用价值的夹竹桃科和马钱科植物,在鸡骨常山属、萝芙木属和钩吻属植物中比较常见。这些结构独特的天然生物碱具有抗炎、抗癌、抗高血压、抗利什曼原虫和抗疟原虫等多种重要的生物活性。由于其独特的化学结构和重要的生物活性,近50年来,该类生物碱一直是合成化学家研究的热点。此前,还没有一个普适性的合成方法来实现该类生物碱的集群式合成。
逆合成分析如图2所示,作者认为这些生物碱可以通过共同的中间体16来合成,他们设计了新颖的Mannich型串联环化反应,可由含吲哚的链状分子19一步合成得到氮杂八元环中间体16。尽管该课题组在前期工作中发展了Prins环化构建含氧桥的中等环系的合成方法(Org. Lett., 2019, 21, 1881),但通过设想的串联环化来实现9-氮杂双环[3.3.1]壬烷骨架的构建仍存在一定的挑战。
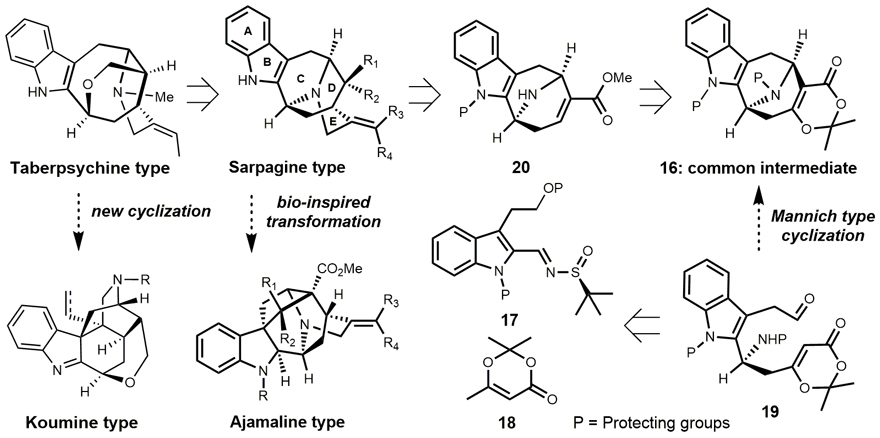
图2. 逆合成分析
他们基于前期发展的不对称插烯Mannich反应(Angew. Chem. Int. Ed., 2017, 56, 12327),构建了该类生物碱的含氮手性中心(图3,17b→19a)。而后,顺利实现了预想的Mannich型串联环化(19e→16a),高效、快捷地构建了该类天然产物的9-氮杂双环[3.3.1]壬烷骨架。
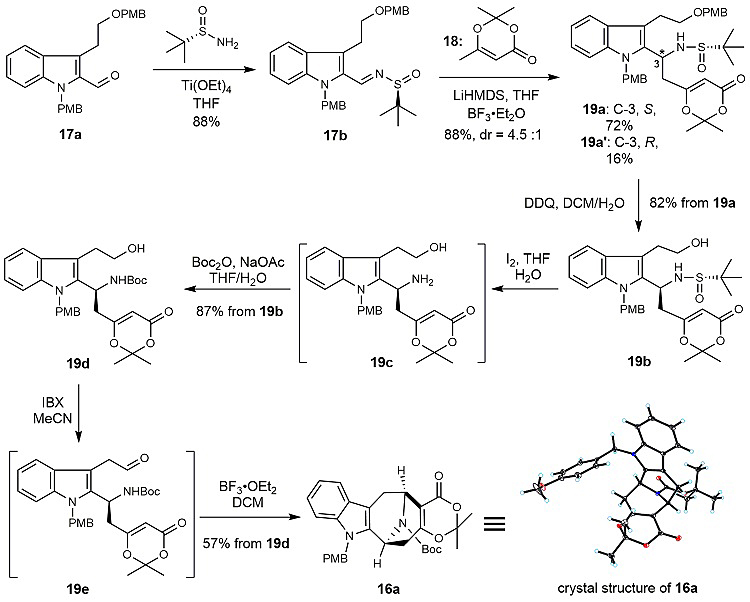
图3. 9-氮杂双环[3.3.1]壬烷骨架的构建
合成得到9-氮杂双环[3.3.1]壬烷骨架化合物16a后,作者原计划用还原型Heck反应或者自由基环化来构建Sarpagine型吲哚生物碱的最后一个环系(20c→20d),然而,经过大量的尝试均未成功。于是,作者又发展了一种SmI2介导的高立体选择性的自由基环化(图4),成功构建了该环系(22→23)。大量的实验研究后他们发现:可通过Wittig反应构建所需的E式双键(23→24),还可通过Julia烯化反应构建所需的Z式双键(23→25)。
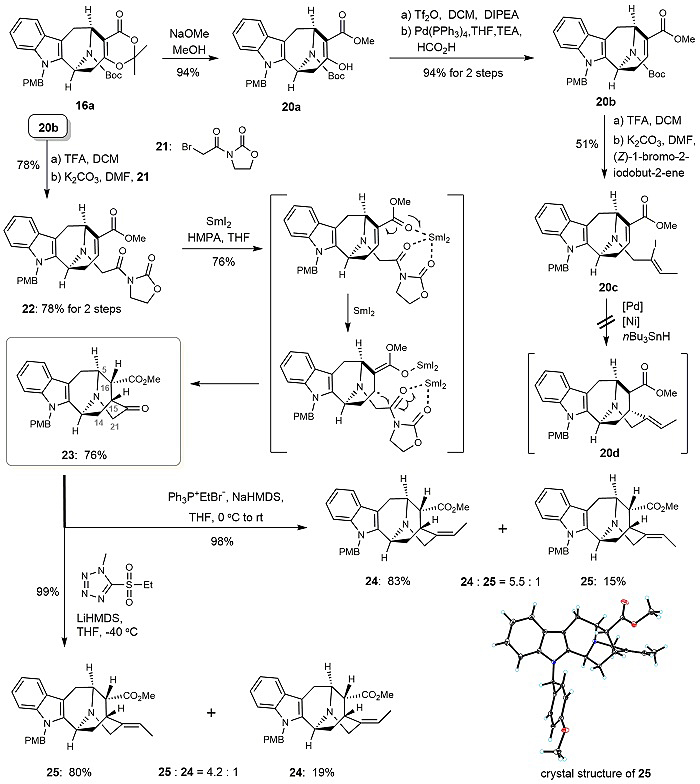
图4. 合成Sarpagine型吲哚生物碱的骨架
合成得到的Sarpagine型吲哚生物碱骨架24再经Aldol反应构建Sarpagine型吲哚生物碱C-16位的季碳中心,以72%收率和3.2:1的dr值得到了构型正确的化合物26及其差向异构体27(图5)。差向异构体27可通过逆Aldol反应进行回收利用。脱除26的保护基后即可实现Akuammidine的首次全合成。经相同的方法,从25出发即可实现19-Z-akuammidine的首次全合成。
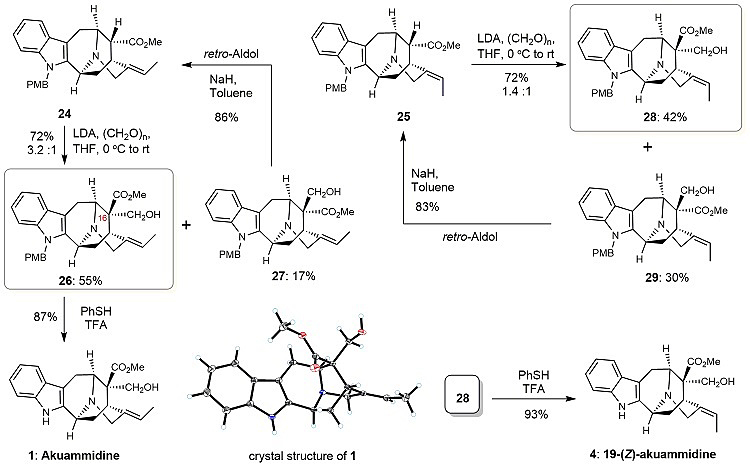
图5. Akuammidine 和19-Z-akuammidine的合成
合成得到的Sarpagine型吲哚生物碱骨架24在HMPA和LDA作用下与多聚甲醛发生Aldol反应(图6),C-16位季碳中心所需构型产物27较没有HMPA存在下有所增加,差向异构体26通过逆Aldol反应可以转化为24。化合物27脱除PMB保护基后,即可得到天然产物Polyneuridine,经Corey-Kim氧化得到Polyneuridine aldehyde,再在酸性条件下发生生源启发的环化反应,生成硅胶柱层析不可分的一对非对映异构体30a和30b。30a和30b的混合物还原亚胺后,可选择性脱除其中一种构型的乙酰基,得到极性相差较大且硅胶柱层析可分的Vincarine和31a。Vincarine与甲醛发生还原胺化后,即可得到天然产物Vincamajinine。化合物31a脱除乙酰基后即可得到天然产物Quebrachidine。同时,化合物31a与甲醛经还原胺化后,可得到天然产物Vincamedine,再脱除乙酰基后即可得到天然产物Vincamajine。Vincamedine、Vincarine、Quebrachidine和Vincamajine等4个含E式双键Ajamaline型吲哚生物碱为首次全合成。

图6. Ajamaline型吲哚生物碱的合成
在完成了上述5个含E式双键的Ajamaline型吲哚生物碱的全合成后,作者着手含Z式双键的Ajamaline型吲哚生物碱Alstiphylianine J的全合成研究。从含Z式双键的化合物25出发(图7),采用与图6中合成Vincarine和31a相同的合成方法,可得到36和35a。C-17位构型不对的化合物36可经氧化,得到醛33后进行回收利用。化合物35a与3,4,5-三甲氧基苯甲酰氯在DMAP和吡啶存在条件下反应即可完成含Z式双键的Ajamaline型生物碱Alstiphylianine J的首次全合成。
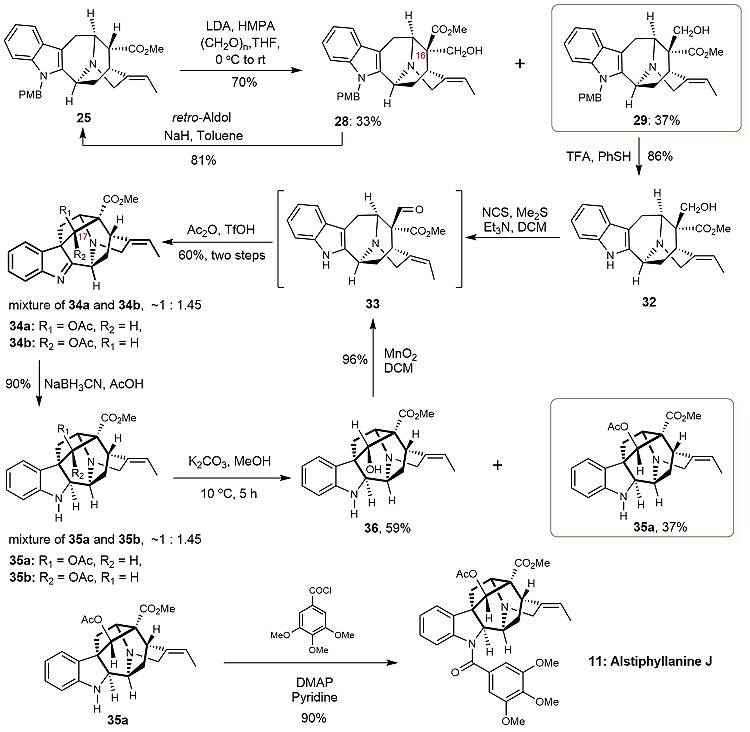
图7. Alstiphylianine J的合成
在完成Ajamaline型吲哚生物碱的全合成后,作者又进行了Taberpsychine型和Koumine型吲哚生物碱的合成研究。要合成这两种类型的天然产物,首先需要解决的问题是如何翻转化合物25中C-16位的手性中心。经过大量的实验研究,作者发现:其酯基α-位的碘代物25b在光照和光催化剂存在的条件下可以生成C-16位所需的构型产物25a。经脱保护基和还原甲酸甲酯基后,即可得到天然产物Koumidine。Koumidine在氯甲酸甲酯存在条件下可以生成Taberpsychine型的酰胺化合物37,经四氢锂铝还原后即可得到天然产物19-Z-Taberpsychine。作者还发现化合物37在NIS的作用下发生碘鎓诱导的吲哚亲电环化反应,生成含两个连续季碳的Koumine型吲哚生物碱骨架的碘代物38。在银盐的参与下发生β-消除反应,得到化合物39,经四氢锂铝还原后,得到天然产物Dihydrokoumine,再经氧化,即可完成天然产物Koumine的全合成。其中天然产物Dihydrokoumine为首次全合成。
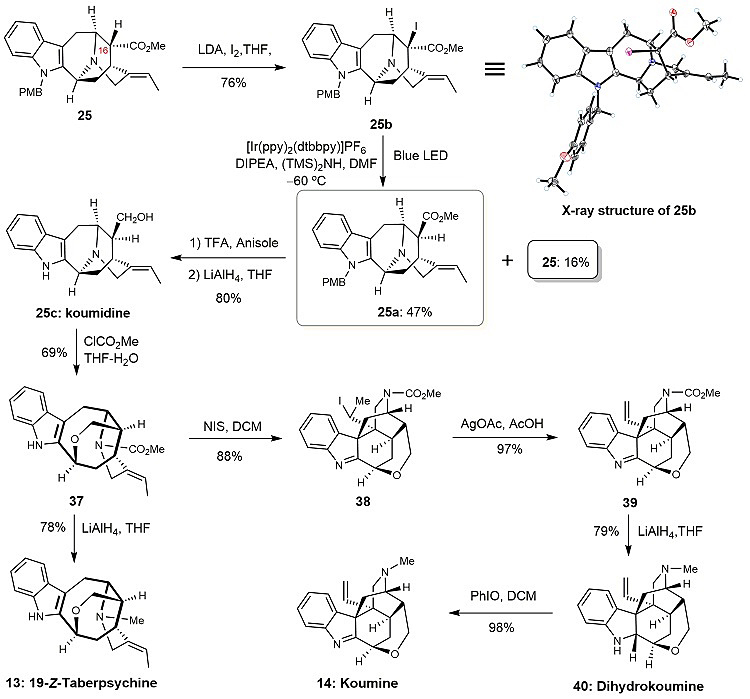
图8. Taberpsychine型和Koumine型吲哚生物碱的合成
该成果得到了国家自然科学基金、教育部创新团队发展计划、国家重点研发计划、云南省科技领军人才项目、云南省“云岭学者”、云南省“优青”、云南省高层人才培养计划及云南大学“东陆人才计划”的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure units oriented approach towards collective synthesis of sarpagine-ajmaline-koumine type alkaloids
Wen Chen, Yonghui Ma, Wenyan He, Yinxia Wu, Yuancheng Huang, Yipeng Zhang, Hongchang Tian, Kai Wei, Xiaodong Yang* & Hongbin Zhang*
Nat. Commun., 2022, 13, 908, DOI: 10.1038/s41467-022-28535-x
陈文博士简介

陈文,云南大学自然资源药物化学教育部重点实验室副研究员、硕士生导师,分别于2008年和2011年获云南民族大学学士和硕士学位,2014年获云南大学博士学位,2015年留校工作,2018年入选云南省高层次人才培养计划“青年拔尖人才”,2019年获云南省“优青”资助。现主要从事具有生理活性的天然产物不对称全合成、药物设计与合成研究。
羊晓东教授简介

羊晓东,云南大学自然资源药物化学教育部重点实验室教授、博士生导师,分别于2003年和2006年获云南大学硕士和博士学位,2014年获“云南省中青年学术和技术带头人”称号,2019年入选云南省“云岭学者”。主要研究兴趣为碳-碳键偶联反应的有机合成方法学;生物活性天然产物的合成;药物分子的设计、合成及构效关系研究。
张洪彬教授简介

张洪彬,云南大学自然资源药物化学教育部重点实验室教授、博士生导师,1985 年获云南大学理学学士学位,1988年获中科院上海药物所硕士学位,1998年获澳大利亚国立大学博士学位,2009年获国家杰出青年科学基金资助,2016年入选国家高层次人才特支计划领军人才,2018年入选云南省科技领军人才。
张老师主要研究兴趣集中在:基于串联反应的天然产物结构单元的合成新方法研究;复杂天然产物的合成以及生物活性分子的设计、合成与构效关系研究。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






































 京公网安备 11010802027423号
京公网安备 11010802027423号