Nat. Chem.:全合成9种longiborneol倍半萜类化合物
自人类首次从自然界中分离出天然产物后,化学家们就一直不断地尝试人工合成天然产物的新方法,包括天然产物的半合成、全合成以及生物合成等。在众多类型的天然产物中,桥联多环萜类化合物备受青睐,这可能是由于其含有独特的刚性环骨架、手性结构和多修饰位点,并且广泛应用于药物分子、功能材料等领域中。如图1a所示,这类分子的典型代表是长叶烯(longifolene,1),有机合成大师E. J. Corey利用逆合成分析策略,从双环2出发,巧妙的利用分子内Micheal加成构筑桥环体系,最终以15步实现了长叶烯(1)的全合成。该策略的特点是在合成后期引入目标分子的大部分拓扑复杂性,目前已成功地应用于各种结构复杂天然产物的构建,例如:Ihara等人从前体4出发,利用[4+2]环加成在后期构建[2.2.1]双环骨架,最终以16步实现了相关天然产物longiborneol(3)的全合成(图1b)。
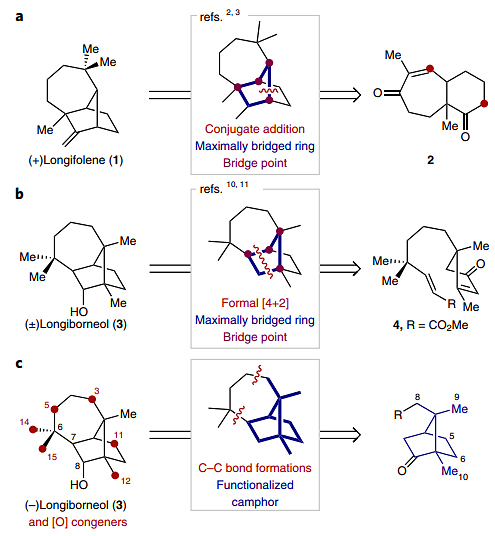
图1. 长叶烯和longiborneol的逆合成分析。图片来源:Nat. Chem.
近日,美国加州大学伯克利分校(UC Berkeley)化学系的Goh Sennari 博士和Richmond Sarpong教授等人发展了一种拓扑复杂性在一开始就被引入的正交策略(图1c),实现了9种longiborneol倍半萜类化合物的简洁全合成(图2b)。具体而言,从简单易得的(S)-香芹酮(19)出发,经骨架重排得到关键的中间体8-羟基樟脑(18),后者与卤代烷17反应得到中间体16,随后经金属氢化物氢原子转移(metal-hydride hydrogen atom transfer,MHAT)引发的不寻常环化得到共同的中间体15。这意味着从(S)-香芹酮(19)出发,仅需9步便可合成longiborneol (3),这也是迄今为止最短的全合成路线。此外,作者还通过后期C-H键官能团化策略,成功地合成了各种含氧longiborneol化合物(5-14)。相关成果发表在Nature Chemistry 上。
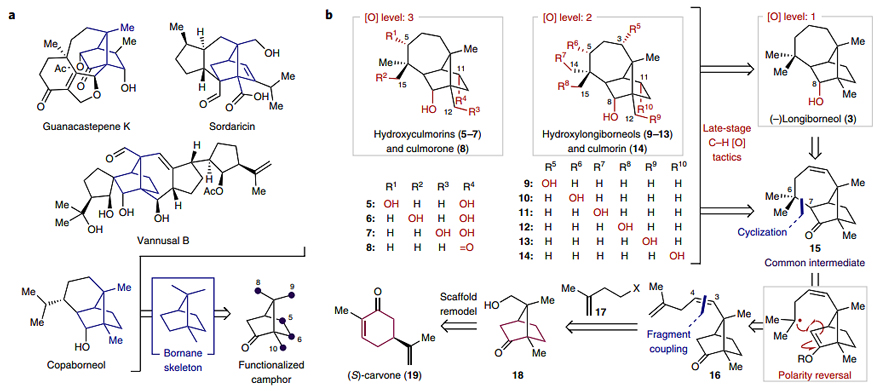
图2. 结构类似天然产物及longiborneol的逆合成分析。图片来源:Nat. Chem.
如图3a所示,具体合成路线如下:从(S)-香芹酮(19)出发,经环氧化、Ti(III)介导的酮还原环化两步转化,以较好的收率得到环丁醇20及其C7差向异构体20'(d.r.=1.5:1)。接着,20经Brønsted酸介导的半频哪醇重排产生8-羟基樟脑(18),随后被氧化为相应的醛(21),21再与衍生自22的磷叶立德发生选择性Wittig烯化反应,以90%的收率得到单一的异构体16,后者包含了longiborneol及其结构相关同系物的所有碳原子。为了实施MHAT引发的环化反应,作者需要确定一种合适的烯烃偶联配偶体。尽管目前已经报道了许多亲电自由基与多种氧官能团化烯醇受体的极性匹配加成,但本文计划的自由基供体和受体却呈现出极性不匹配(图3b)。鉴于烯醇衍生物是MHAT反应中合适的氢原子受体,因此作者推测使用缺电子烯醇衍生物或许会有所不同。为此,作者筛选了16的几种烯醇衍生物,结果显示当用NaHMDS和苯磺酸酐处理酮16时,几乎以定量的收率得到乙烯基苯磺酸酯23,随后在Fe-H HAT条件下进行环化反应,以85%的收率得到产物15(图3a)。接着,15经烯烃氢化、酮的非对映选择性还原,最终以9步、30%的总收率实现了longiborneol(3)的全合成,并且每步都能以克级规模进行制备。
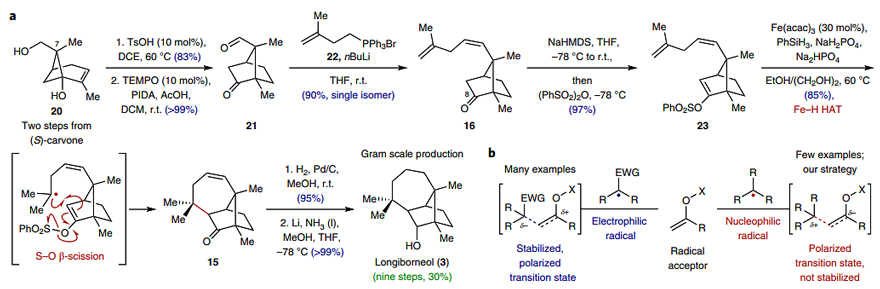
图3. longiborneol的全合成。图片来源:Nat. Chem.
鉴于15是许多含氧longiborneol同系物的共同中间体,因此作者从15出发,先对C3-C4双键进行区域选择性和非对映选择性Mukaiyama水合反应,从而有效地在C3上安装一个羟基;接着对C8位酮羰基进行还原,便可以9步、26%的总收率得到3-羟基longiborneol(9,图4a)。类似地,15经SeO2介导的烯丙基氧化,非对映选择性地在C5上安装一个羟基;接着对烯烃和C8位酮羰基进行还原,最终以10步、15%的总收率得到5-hydroxylongiborneol (10)。随后,作者尝试对isolongiborneol (27) 进行Suárez反应以合成14-hydroxylongiborneol (11) 或15-hydroxylongiborneol (12)。遗憾的是,反应都以失败告终,这可能是由于张力[2.2.1]双环发生了动力学上有利的β-裂解。因此,作者将注意力转向接力氧化策略(图4b)。具体而言,15经六步转化得到肟25,后者经钯催化的C-H键乙酰氧基化得到了C14和C15位双乙酰氧基化产物。对反应条件进行优化后,作者发现使用0.9 equiv.的PIDA并显著降低反应温度(100 °C→40 °C)后,能够以2:1的d.r.值获得乙酰氧基化中间体26,后者经肟还原裂解、亚胺水解、甲苯磺酰腙形成和LiAlH4介导的Caglioti反应,即通过C5→C14/C15的接力羟基化分别完成了14-hydroxylongiborneol(11,17步,总收率:5%)和15-hydroxylongiborneol(12,17步,总收率:3%)的全合成。
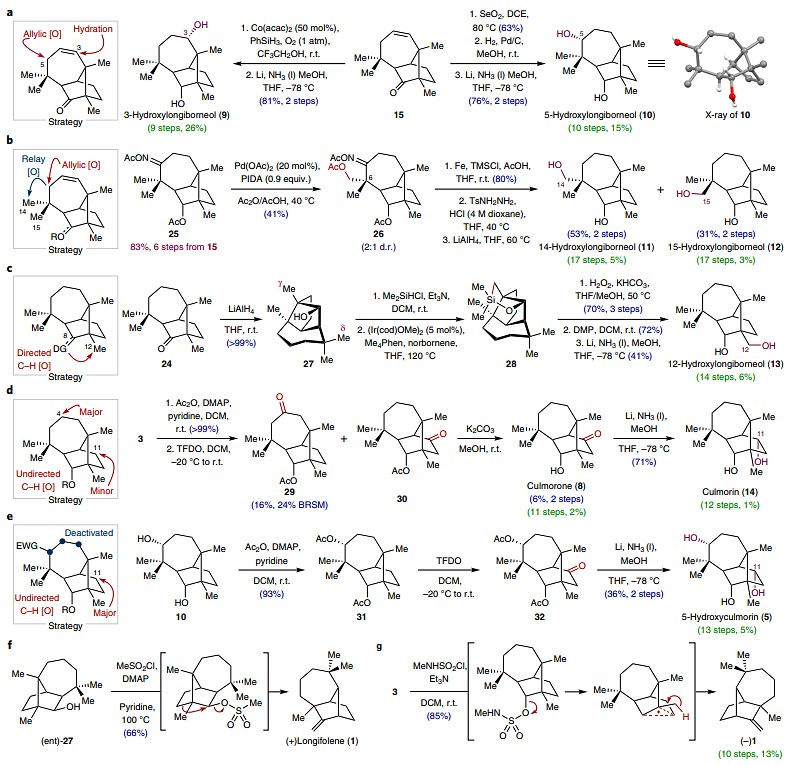
图4. 含氧longiborneol同系物的合成。图片来源:Nat. Chem.
起初,作者认为12-hydroxylongiborneol (13) 可以通过C8导向的C12 C-H键官能团化来制备(图4c),但所有的尝试均未成功,这可能是由于酮羰基周围的空间位阻所致。因此,作者将注意力转向了Hartwig等人发展的导向C-H键硅烷基化。另一方面,通过LiAlH4还原longicamphor (24) 得到的isolongiborneol (27) 被证明是一种更有效的底物。事实上,用氯二甲基硅烷处理27得到二甲基甲硅烷基醚,后者经铱催化的C-H键硅烷基化得到硅环28。接着,28经Tamao-Fleming氧化得到iso-12-hydroxylongiborneol,后者经羟基氧化、羰基还原,最终以14步、6%的总收率得到12-hydroxylongiborneol (13)。鉴于C11与从15衍生的潜在导向基距离较远,因此作者尝试利用无导向的C-H键氧化来合成culmorone (8)和culmorin (14)。经过广泛的实验筛选,作者最终确定甲基(三氟甲基)二环氧乙烷(TFDO)是acetyl-longiborneol非导向C-H键氧化的最有效试剂,并且得到了C4氧化为主要产物(29,产率:16%),同时还观察到C11氧化(30)、C3(6%产率)和C5氧化产物以及几种未鉴定的副产物。随后,30在碱性条件下进行水解便可实现culmorone (8,11步,总收率:2%) 的直接合成;后者经金属还原便得到了culmorin (14,12步,总收率:1%)。尽管acetyl-longiborneol的非导向C-H键官能团化选择性较差,但若在七元环上安装额外的吸电子基团或许会减慢C3、C4和C5的氧化速率(图4e)。事实上,TFDO介导的双乙酰化5-hydroxylongiborneol (31) 的C-H键氧化反应在C11处更具选择性,接着将反应后的粗混合物置于金属还原条件下,便能有效地制备5-hydroxyculmorin (5,13步,总收率:5%)。有趣的是,在C-H键官能团化研究过程中,作者还观察到了longiborneol骨架的重排(图4g)。例如:用甲基氨磺酰氯处理longiborneol(3),能以较好的收率(85%)得到唯一的产物——长叶烯(1,10步,总收率:13%),这也是迄今为止最短的合成路线。
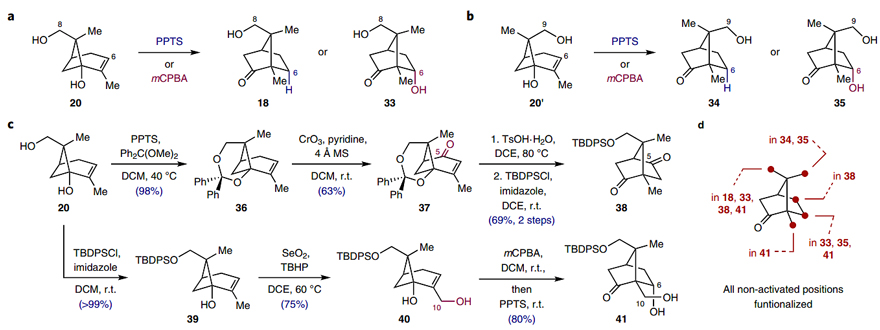
图5. 通过(S)-香芹酮骨架重塑获得樟脑衍生物。图片来源:Nat. Chem.
如图5所示,本文的全合成策略依赖于香芹酮(19)的骨架重排,这意味着这种潜在的多功能策略可以用来合成其它复杂分子所需的多种樟脑衍生物。例如:环丁醇20及其非对映异构体(20')可分别转化为相应的衍生物18、33、34和35(图5a、5b)。此外,在半频哪醇重排之前对环丁醇骨架进行氧化则可以提供额外的樟脑衍生物。具体来说,用CrO3氧化中间体36上的烯丙基亚甲基,接着再经两步转化便可得到C5氧化的衍生物38。或者,用SeO2选择性氧化烯丙基甲基便会产生C10氧化的衍生物41(图5c)。也就是说,利用骨架重排策略可以顺利地实现未活化位点的官能团化,从而制备一系列樟脑衍生物(图5d)。
总结
Sarpong教授团队利用骨架重排策略高效获得了longiborneol骨架8-羟基樟脑的拓扑复杂核心结构,从而实现了longiborneol的简短全合成。另一方面,作者还采用各种后期C-H键官能团化策略(如:烯丙基氧化、非定向二氧杂环丙烷C-H键氧化、氧基硅烷导向的C-H键硅烷基化和肟导向的C-H键乙酰氧基化等)完成了另外八种含氧同系物的全合成。此外,类似的策略还能实现樟脑上未活化位点的直接官能团化,从而可以制备多种其它天然产物。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of nine longiborneol sesquiterpenoids using a functionalized camphor strategy
Robert F. Lusi , Goh Sennari , Richmond Sarpong
Nat. Chem., 2022, DOI: 10.1038/s41557-021-00870-4
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!







































 京公网安备 11010802027423号
京公网安备 11010802027423号