铂配合物抑制肿瘤细胞的新机制——诱发内质网应激介导的线粒体自噬
自上世纪80年以来顺铂(CDDP)等铂类抗癌药物已经在全世界被广泛用于治疗各种恶性肿瘤;DNA被认为是这类药物的作用靶点,凋亡是导致癌细胞死亡的主要方式。然而,不良反应和耐药性常常困扰着铂类药物的临床治疗效果,因此需要开发新的药物克服这些问题。根据铂类药物的经典构效关系,有抗癌活性的铂配合物必须能与DNA形成加合物,这已成为设计铂类药物的基本要求,而各种蛋白质和信号通路在抗肿瘤机制中的作用却在设计实践中大大忽视。南京大学郭子建院士和王晓勇教授研究团队2003年合成了一个单功能铂配合物Mono-Pt,它不与DNA反应诱导细胞凋亡,但对多种癌细胞显示出很强的细胞毒性(图1)。后来他们证明这个配合物通过自噬途径杀死癌细胞,这与CDDP的作用机制完全不同,但其详细机制尚未完全阐明。
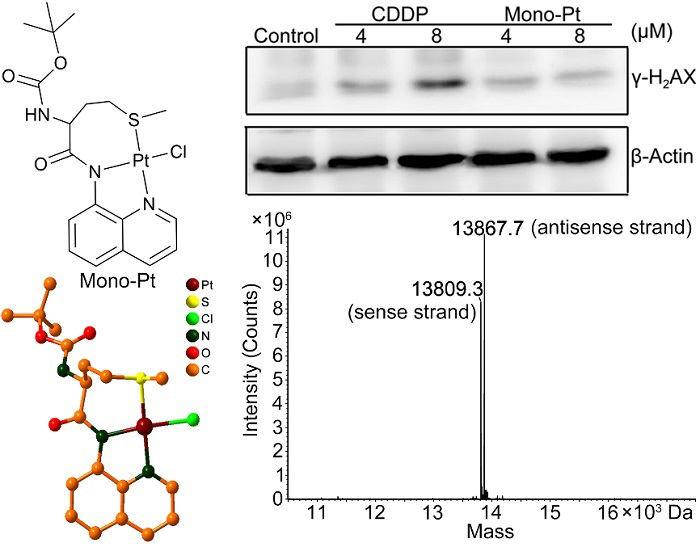
图1. Mono-Pt的结构及其与Caov-3卵巢癌细胞或DNA45孵育24 h后的γ-H2AX表达和LC-MC谱
最近,他们又对Mono-Pt的作用机制进行了深入研究,发现其能破坏内质网的正常功能,刺激内质网应激(ERS)并通过PERK-ATF4-CHOP通路激活未折叠蛋白反应(UPR),使线粒体结构和功能严重受损,包括破坏膜完整性、降低膜电位、提升活性氧水平、抑制mtDNA转录及ATP生成等,最终导致癌细胞发生线粒体特异性自噬或线粒体自噬(图2)。
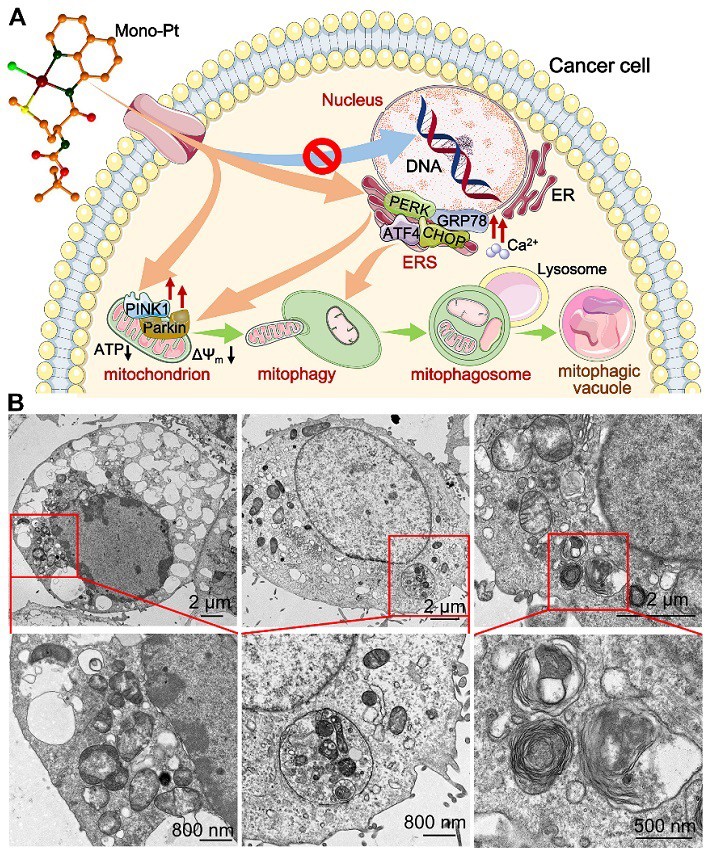
图2. Mono-Pt的抗肿瘤作用机制(A)及其诱导Caov-3细胞线粒体自噬的TEM 图像(B)
以上机制可以通过PERK、ATF4、CHOP、GRP78、PINK1、Parkin等蛋白的上调(图3)以及细胞内Ca离子水平的升高得到证实。Mono-Pt通过诱导线粒体去极化、降低细胞ATP水平和ATP酶活性、增加mtROS产生、抑制mtDNA转录诱导线粒体功能障碍,所以线粒体深度参与了Mono-Pt抗癌活性的调节。
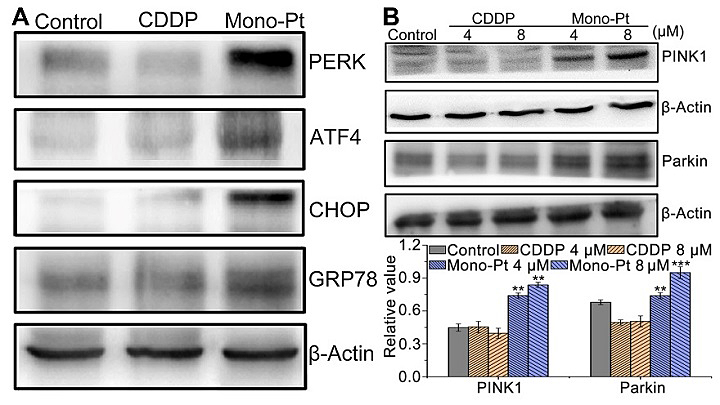
图3. CDDP和Mono-Pt(4 μM)分别与Caov-3细胞共孵育24 h后内质网应激(A)和线粒体自噬(B)相关蛋白的表达
铂类抗癌药物的设计一直受DNA结合理论的主导,坚守这一理论已经极大地影响了铂配合物设计的结构创新。南京大学的这项研究证明与DNA结合并不是二价铂配合物显示抗肿瘤活性的先决条件,有些铂配合物不引起DNA损伤和凋亡,但通过刺激内质网和线粒体诱导内质网应激和线粒体自噬也能导致肿瘤细胞死亡。铂配合物的促自噬作用是一种新的抗癌途径,它改变了铂类药物设计的DNA结合范式,突破了DNA损伤诱导凋亡的作用机制,颠覆了铂配合物的经典构效关系,为开发新的铂类抗癌药物拓宽了道路。由于铂类抗癌药物的不良反应和耐药性大多与DNA损伤有关,如果配合物不与DNA作用,相关的毒副作用将不复存在,这为铂类药物的设计和应用创造了巨大的发展空间。
研究论文发表在J. Med. Chem.,第一作者是南京大学化学化工学院的郭艳博士,通讯作者是南京大学医药生物技术国家重点实验室的王晓勇教授和南京大学配位化学国家重点实验室的郭子建教授和金素星博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

DNA-Unresponsive Platinum(II) Complex Induces ERS-Mediated Mitophagy in Cancer Cells
Yan Guo, Suxing Jin*, Hao Yuan, Tao Yang, Kun Wang, Zijian Guo*, and Xiaoyong Wang*
J. Med. Chem., 2022, 65, 520–530, DOI: 10.1021/acs.jmedchem.1c01690
导师介绍
郭子建
https://www.x-mol.com/university/faculty/11597
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号