德州大学医学分部JMC封面:新型BRD4小分子抑制剂及变构位点的首次发现
慢性阻塞性肺病 (Chronic obstructive pulmonary disease; COPD) 是一种以持续的呼吸道症状和肺气流受限为特征的呼吸系统疾病,确切病因不明,具有高发病率、高死亡率。半数以上的急性失代偿性慢阻肺患者会同时并发呼吸道病毒感染,进一步引起白细胞炎症、黏膜生成及呼吸道高反应性。目前临床上的治疗手段(如支气管扩张剂)只能缓解患者的急性症状,不能根治疾病。
美国德克萨斯大学医学分部 (UTMB) 药理系药物化学家周嘉 (Jia Zhou) 教授、内科医学系分子生物学家田滨 (Bing Tian) 教授及威斯康辛大学临床转化医学科学家Allan. R. Brasier教授团队前期研究发现,含溴结构域蛋白4 (BRD4) 参与NFκB/RelA信号通路、介导先天性免疫反应。活化的转录因子NFκB/RelA可以激活BRD4自身的非典型组蛋白乙酰化转移酶作用功能、RNA聚合酶II的磷酸化,及炎症细胞和多种重要细胞趋化因子的分泌 (J. Virol., 2017, 91, e00007-17; J. Virol., 2018, 92, e00441-18; J. Allergy Clin. Immunol., 2019, 143, 1380−1394; Cell Rep., 2018, 23, 1138−1151; Drug Discov. Today, 2020, 25, 126-132)。作为表观遗传密码的解读蛋白,BRD4参与多种肿瘤、炎症等疾病的发生发展过程,是处于国际前沿的新靶标蛋白。团队前期发现的先导化合物ZL0454 (Eur. J. Med. Chem., 2018, 151, 450−461),同靶蛋白BRD4的亲和力为IC50= 49 nM,注射给药时具有良好的体内外抗呼吸道炎症和肺纤维化活性,但是体内代谢性质不佳,口服生物利用度不高 (F = 0.5%)。通过调整核心骨架结构获得的口服有效BRD4抑制剂ZL0516 (J. Med. Chem., 2020, 63, 5242−5256),保持了体内外抗呼吸炎症活性,利用非保守Asn93实现对BRD4 BD1一定的选择性,生物利用度提高到F = 35% (图1)。ZL0454 和ZL0516与BRD4 BD1的共晶结构分析显示,这两类BRD4抑制剂和传统广为人知的 (+)-JQ1一样都作用在经典的乙酰化赖氨酸KAc结合口袋。
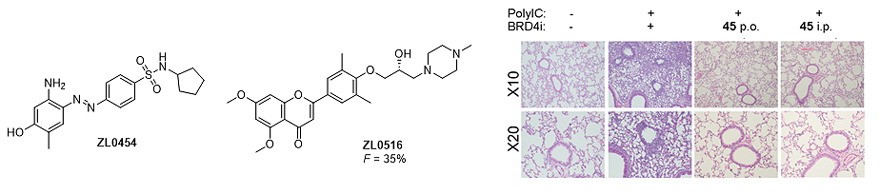
图1. 前期工作发现的新型BRD4抑制剂ZL0454及ZL0516
近日,该团队利用基于性质的药物设计方法,将ZL0454中的N=N结构替换为脲,并进行系统的结构优化和构效关系研究后得到了新型BRD4抑制剂ZL0590。化合物具有良好的水溶性和较高的BRD4 BD1选择性 (IC50 = 90 nM)。口服10 mg/kg ZL0590在动物模型上可以显著抑制poly(I:C)诱导的急性呼吸道炎症,炎症细胞和多种重要细胞趋化因子的分泌 (图2)。
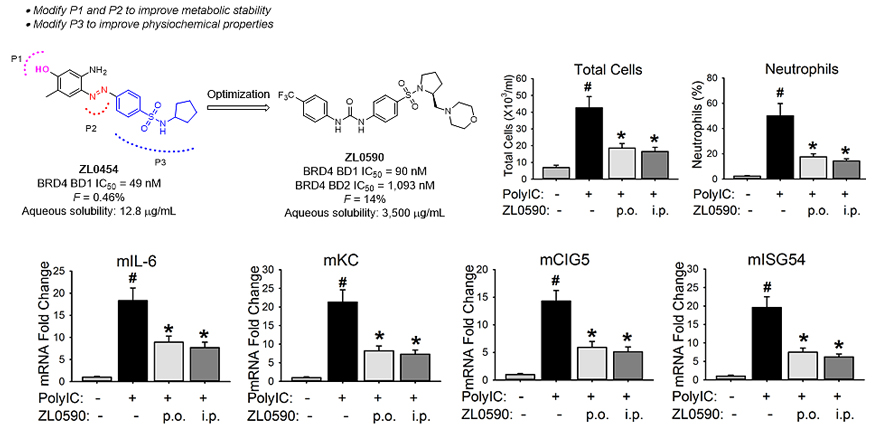
图2. 本工作发现的ZL0590体外活性及体内抗呼吸炎症药效
团队培养了ZL0590与BRD4 BD1的共晶,首次发现不同于一般的小分子抑制剂,ZL0590结合在一个全新的变构位点,而非经典的乙酰化赖氨酸KAc结合口袋。该变构位点处于α螺旋B和C之间,与经典的KAc口袋背靠背。氨基酸残基Glu151同ZL0590的碱性N形成盐桥,Gly143同羰基O具有氢键作用,另外还有多个由水分子介导的与Glu154、Tyr137和Asp144等形成的氢键作用 (图3)。
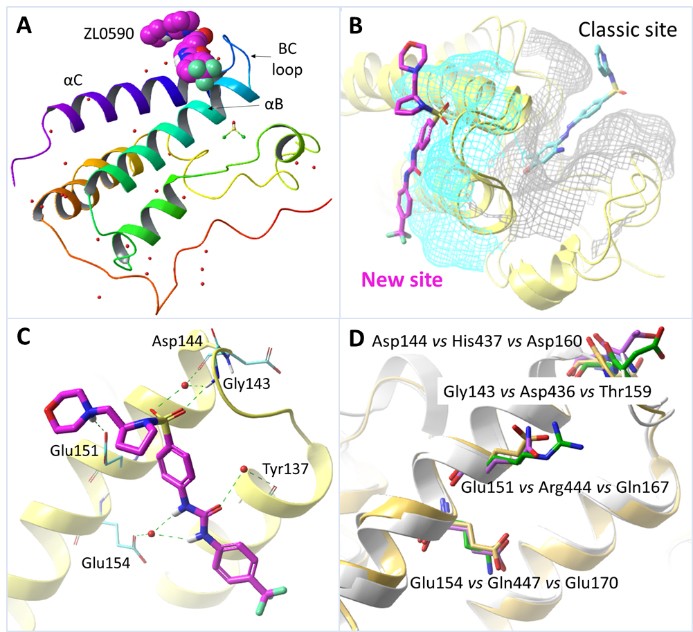
图3. 先导物ZL0590与BRD4 BD1的共晶揭示了全新变构调节位点
在此其关键作用的氨基酸Glu151、Gly143等氨基酸为BRD4 BD1特有,可能对其选择性的实现至关重要。因此,团队和美国德州大学西南医学中心的江正明(Cheng-Ming Chiang)教授合作,利用Glu151单点氨基酸突变结合thermal shift assay (TSA) 对其结合功能进行了验证。ZL0590与野生型的BRD4 BD1结合产生非常显著的ΔTm ~ 15 ℃,而ZL0590与BRD4 BD2及Glu151突变的BRD4 BD1结合很弱或丧失而只产生微弱的ΔTm ~1 ℃ (图4)。氨基酸突变结合研究结果进一步证实共晶所揭示的小分子ZL0590和BRD4 BD1变构调节位点实质性结合的真实性,而不仅仅是简单的物理接触假象。
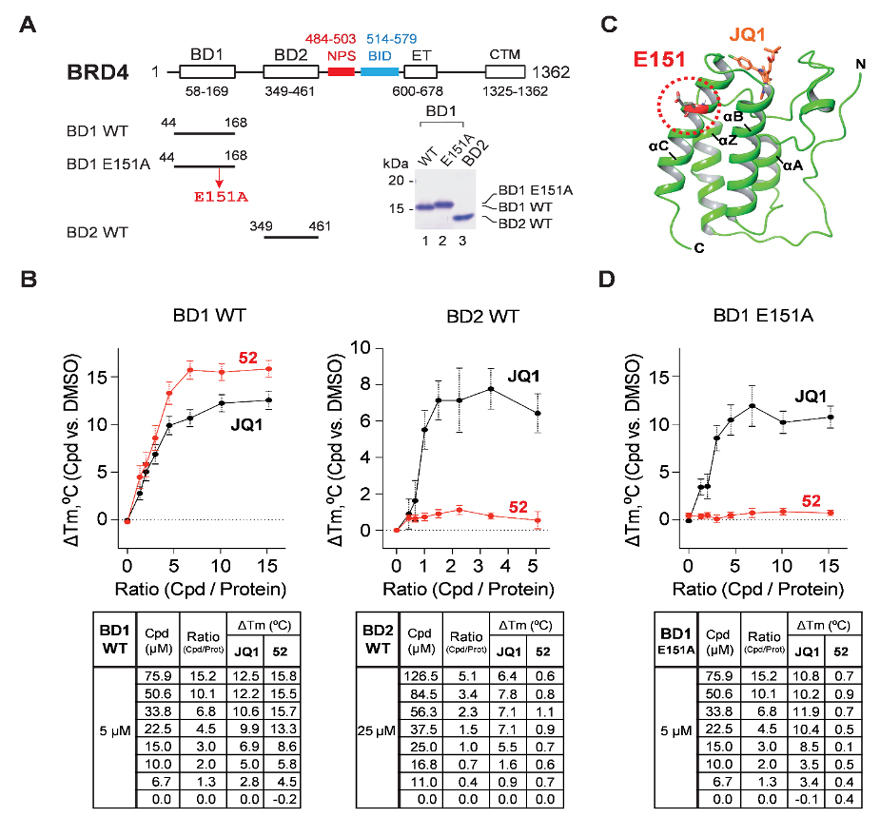
图4. 先导物ZL0590与野生型BRD4 BD1、BD2及Glu151突变型BRD4 BD1结合作用研究
该研究首次报道了BRD4 BD1的变构调节位点,为新型抗炎剂包括慢阻肺等呼吸系统疾病 (COPD)和炎性肠病(IBD)及其他重大疾病的药物开发提供了新思路。这一新的变构调节位点的发现对研究BRD4相关的表观遗传系统及精细调控蛋白-蛋白相互作用的生物学功用阐述有重大意义。例如,团队在和该校微生物和免疫系的胡海涛 (Haitao Hu) 教授合作研究发现,ZL0590的类似物ZL0580能有效地抑制艾滋病 (HIV) 病毒复制 (J. Clin. Invest., 2019, 129: 3361-3373),生物功能完全不同于传统结合模式的(+)-JQ1。相反地,文献报道(+)-JQ1能够激活HIV病毒潜伏。
该成果于近日发表于药物化学领域顶级期刊Journal of Medicinal Chemistry 上,并入选期刊封面文章。美国德克萨斯大学医学分部周嘉教授、田滨教授和美国威斯康辛大学Allan R. Brasier教授为该论文的共同通讯作者。刘志清博士、李翼博士为该论文的共同第一作者。周嘉博士被选为美国National Academy of Inventors (NAI) Fellow,并担任药物化学杂志 Current Topics in Medicinal Chemistry的主编 (Editor-in-Chief)。刘志清博士现为中国海洋大学“青年英才工程”第一层次特聘教授,博士生导师。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery, X-ray Crystallography, and Anti-inflammatory Activity of Bromodomain-containing Protein 4 (BRD4) BD1 Inhibitors Targeting a Distinct New Binding Site
Zhiqing Liu, Yi Li, Haiying Chen, Hsien-Tsung Lai, Pingyuan Wang, Shwu-Yuan Wu, Eric A. Wold, Paul G. Leonard, Sarah Joseph, Haitao Hu, Cheng-Ming Chiang, Allan R. Brasier*, Bing Tian*, and Jia Zhou*
J. Med. Chem., 2022, DOI: 10.1021/acs.jmedchem.1c01851
相关主创科研人员网页链接:
周嘉博士:
https://www.utmb.edu/phtox/faculty-staff-students/faculty-and-staff/jia-zhou
田滨博士:
https://www.utmb.edu/internalmedicine/divisions/endocrinology/our-team/faculty/bing-tian
刘志清博士:
http://iemb.ouc.edu.cn/2020/0626/c19155a291203/page.htm
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号