利用[3+2]自由基环化反应构建[3.2.1]桥环体系
自由基串联环化反应是构建复杂分子环系的有效方法,分子内的自由基多烯环化反应已被成功地应用于许多复杂天然产物的全合成工作中。然而,分子间的自由基环化反应则具有一定的挑战性,除了控制环化反应的立体选择性和区域选择性之外,还必须有效地控制自由基反应的有序进行。[3.2.1]桥环体系普遍存在于天然产物中,尤其在四环二萜中最为常见。[3+2]自由基环化反应是构建[3.2.1]桥环体系的有效方式(如图1i),但在反应体系中会同时存在三种不同的自由基中间体H、I、J。如何利用有效的氢源将自由基终止在J阶段是个尚未解决的科学问题。

图1. [3+2]自由基环化反应的难点。部分图片来源:J. Am. Chem. Soc.
如果终止试剂太活泼,就会将反应提前终止在H或I阶段,生成副产物L或M。如果太惰性,就会发生过度加成反应,生成副产物N。例如,日本的Ono课题组在1985年发现三级硝基化合物与缺电子双键发生自由基加成反应,这个反应就只发生了一次加成(如图1ii)。Barton等在1988年报道了γ, δ-不饱和羧酸在自由基脱羧条件下与缺电子烯烃发生加成反应,但主要获得了多次自由基加成的产物(如图1iii)。
北京生命科学研究所/清华大学生物医学交叉研究院李超(点击查看介绍)课题组近日在J. Am. Chem. Soc.上发表的一篇研究论文揭示,TEMPO可以有效地调控这个[3+2]自由基环化反应,使反应终止在自由基J阶段,获得目标产物K。利用该方法他们还集群式地合成具有[3.2.1]桥环骨架结构的四环对映-贝壳杉烷型和贝叶烷型二萜(图2)。

图2. 本文主要发现。图片来源:J. Am. Chem. Soc.
作者首先设想对映-贝壳杉烷(A)和贝叶烷(B)二萜分子骨架中C8–C15和C13–C16键可以从相应的高烯丙基三级碳自由基(C和D)与丙烯酸酯经[3+2]自由基环化反应一步构建(图3)。环化后的C16位酯基可以通过简单的官能团转化生成烷烃、烯烃、羧酸、醇等,从而实现C16位具有不同官能团的四环二萜天然产物的合成。基于最近报道的三级醇脱羟基产生三级自由基的多个研究,作者设想自由基中间体(C和D)可以由相应的高烯丙醇(F和G)经C–O键均裂产生。然而这一想法成功的关键是找到一个合适的氢供体,能高效地选择性地还原自由基中间体J。
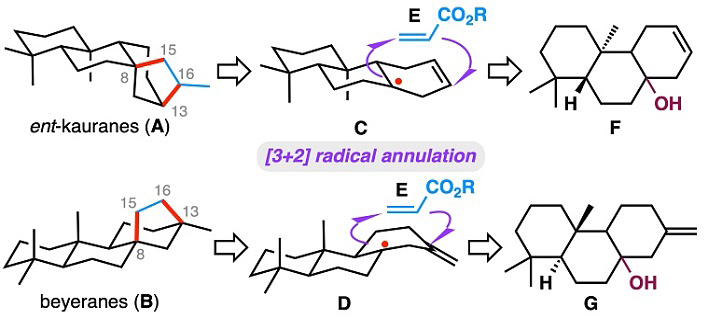
图3. 合成设想。图片来源:J. Am. Chem. Soc.
基于以上考虑,作者首先设计了一条高效合成高烯丙醇1的合成路线(图4)。从已知的化合物反式/反式金合欢醇乙酯出发,经不对成双羟化、环氧化以及三价钛介导的还原环化得到十氢萘化合物4。臭氧解环外双键生成酮,然后用烯丙基溴化镁对所得酮进行1,2-加成并同时脱除C11处的乙酰基,随后选择性地对伯醇进行甲苯磺酰化得到化合物5。该化合物在小极性溶剂甲苯和铜的催化作用下与乙烯基溴化镁发生Kochi-Schlosser偶联得到6。最后通过RCM反应得到高烯丙基三级醇1,化合物1的结构通过X-ray得到证实。这条路线能实现化合物1的克级制备。
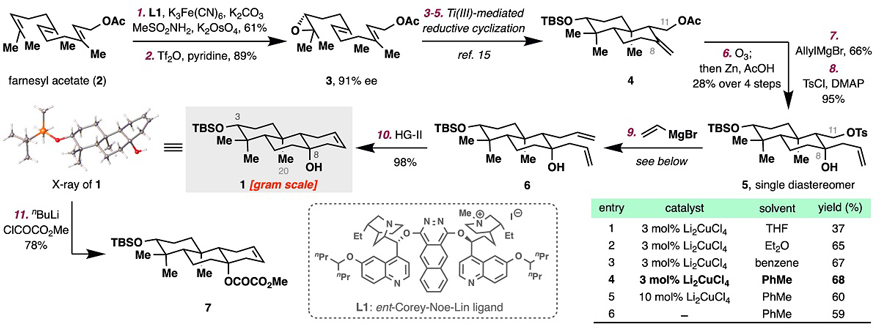
图4. 高烯丙基三级醇1的合成。图片来源:J. Am. Chem. Soc.
能获得化合物1后,作者开始探索[3+2]自由基环化反应。上海大学的龚和贵教授在2019年首次报道了三级醇草酸甲酯在PBI、MgCl2和锌粉的作用下能产生三级自由基(J. Am. Chem. Soc., 2019, 141, 820–824)。受此启发,作者通过大量的反应条件筛选,最终发现以稳定的高烯丙基三级醇草酸甲酯7为原料、锌粉为还原剂、PBI为配体、氯化镁、TEMPO以及 TMSCl为添加剂,可以获得可观收率的目标产物9(图5)。对照试验表明锌粉、PBI、MgCl2以及TEMPO都是必须的(entry 1-4),将PBI换成其它的氮配体或者将MgCl2换成ZnCl2,反应都不会发生。

图5. 最优反应条件与对照试验。部分图片来源:J. Am. Chem. Soc.
作者接着对该反应的机理进行了深入的研究。并经大量的机理实验提出了以下反应机理(图6):首先,作者证明TEMPO在该反应体系下能很快地被还原成Zn(TEMPO)2。接着他们通过对反应的监测、氘代实验以及将Zn(TEMPO)2制备出来代替TEMPO等实验证明二级自由基J与Zn(TEMPO)2发生SH2反应生成锌试剂O,然后中间体O从PBI或者后处理过程中获得一个质子生成产物K。由于位阻作用,三级自由基中间体H不会和大位阻的Zn(TEMPO)2反应。当然还有另一种机理上的可能性不能排除,即Zn(TEMPO)2首先在PBI中获得一个质子生成TEMPOH,二级自由基J从TEMPOH中获得一个氢原子得到目标产物K(HAT反应)。
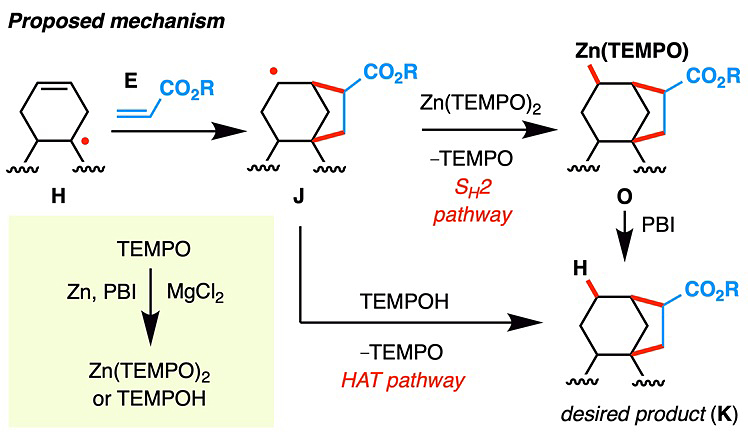
图6. 推测的反应机理。图片来源:J. Am. Chem. Soc.
随后,作者对其底物使用范围进行了考察(图7)。除了丙烯酸苄酯外,丙烯氰和丙烯酸乙酯也可以较好的收率得到化合物13和14。不同氧化态的高烯丙醇1衍生物(15和16)、简单的二环(17)、单环底物(20)以及链状的高烯丙醇也适用于该反应。值得注意的是,化合物23形成的草酸甲酯在标准条件下产生的三级自由基与缺电子双键反应时倾向于从位阻大的一侧与双键加成。虽然具体的原因尚不清楚,但庆幸的是主产物的立体构型与贝叶烷二萜天然产物相同。

图7. 底物适用范围探索。图片来源:J. Am. Chem. Soc.
最后,作者从化合物9、15、16和24出发,经过简单的化学反应集群式地合成了11个对映-贝壳杉烷和贝叶烷型天然产物(图8)。
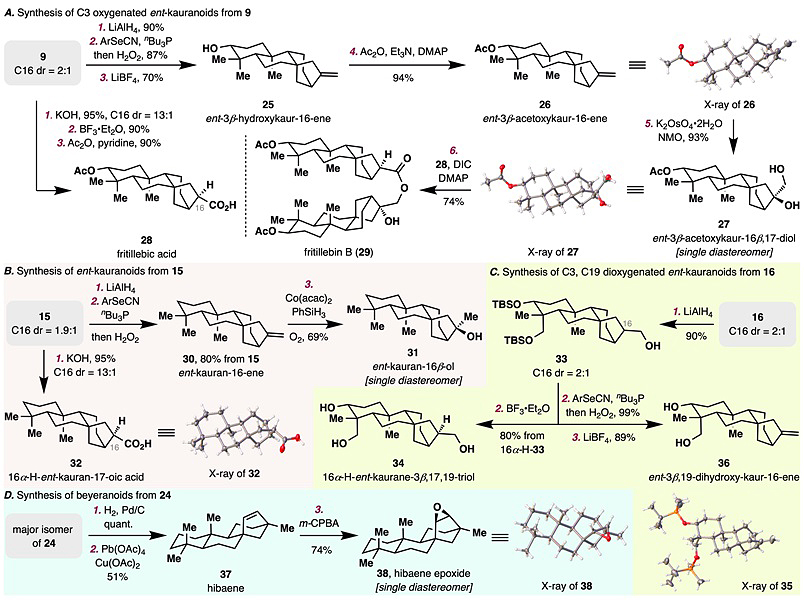
图8. 对映-贝壳杉烷和贝叶烷的集群式合成。图片来源:J. Am. Chem. Soc.
总 结
在天然产物全合成研究中,自由基环化反应是构建复杂环系的有力工具。这项研究工作中,作者发现TEMPO能促进[3+2]自由基环化反应,并以中等收率一步构建[3.2.1]桥环结构。这个反应缩短了合成的线性步骤,提高了合成效率。这对后续合成具有[3.2.1]桥环骨架结构的天然产物提供了可参考的方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Reductive Radical Annulation Strategy toward Bicyclo[3.2.1]octanes: Synthesis of ent-Kaurane and Beyerane Diterpenoids
Junming Zhuo, Chunlin Zhu, Jinbao Wu, Zijian Li, Chao Li*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c11623
关于李超课题组
李超课题组致力于探索高效的构建化学键的方法和策略,以提高天然产物和活性小分子的合成效率。在北京生命科学研究所(NIBS),李超课题组的研究不局限于天然产物全合成和合成方法学,药物化学和化学生物学也是他们探索的方向。
李超课题组诚招热爱合成化学的研究生(直博),研究助理,博士后。年轻的他们期待与您共同成长。(注:表现优秀的研究助理可提供推免博士研究生的机会),有意者请直接联系李超博士(lichao@nibs.ac.cn)。
待遇:
1. 提供与学历和能力相匹配的且有竞争力的工资待遇。
2. 应届博士和硕士毕业生可以解决北京市户口。
导师介绍
李超
https://www.x-mol.com/university/faculty/65940
课题组网站
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号