酶催化的分叉反应:计算研究与实验验证
后过渡态分叉 (post-transition state bifurcation, PTSB) 是指单一过渡态生成多个产物的现象。除了众所周知的热力学、动力学和隧道控制反应选择性外,PTSB还为选择性控制提供了一种新的方式。PTSB在很多反应中都有报道,如周环反应、有机金属反应、硝基插入反应、开环反应和重排反应。
近十年来,PTSB介导的生物合成和酶催化反应逐渐被科研工作者所关注。2011年,Kim等人报道了第一个酶催化[4+2]环加成反应在Spinosyn A生物合成中的应用;2016年,Patel等人基于量子化学计算提出,该反应在生成[4+2]/[6+4]产物时,涉及后过渡态分叉。2017年,Ohashi等人报道了一种S-腺苷-L-甲硫氨酸(S-adenosyl-L-methionine, SAM)依赖的多功能酶LepI,它催化立体选择性脱水,生成一个双模式周环过渡态,该过渡态分叉为分子内Diels-Alder或杂Diels-Alder产物。2019年,Ge、Liang和Tan 团队发现了第一个酶催化的[6+4]环加成反应,并通过实验鉴定了[4+2]和[6+4]产物。
在发现新的PTSB介导的酶反应轨迹上,计算研究发挥了关键作用。利用飞秒时间尺度上的分子动力学模拟,特别是具有量子力学的准经典轨迹模拟,我们可以研究PTSB调控下的反应时间分辨机制。南京大学与范德堡大学的研究团队利用了Houk-Yang环境微扰的过渡态采样方案(environment-perturbed transition state sampling, EPTSS),来研究溶剂和酶中化学反应的准经典轨迹。最近,该团队发现了一种新的周环酶NgnD,它可以催化后过渡态分叉反应,生成[6+4]/[4+2]产物(图1)。NgnD不同于现有的酶催化PTSB反应,[4+2]和[6+4]产物都有实验表征,且[6+4]产物是该反应的主要产物。

图1. [4+2]和[6+4]环加成参与了链霉素的生物合成。
根据NgnD的晶体结构,大部分活性位点残基是疏水的。如图2所示,这些残基与底物分子的作用力包括氢键(Y55)、CH-π相互作用(Y13)、π-π相互作用(W67)、静电/极性相互作用(M69、N87、Q113)和范德华相互作用(I89、V56、F34、P37)。

图2. NgnD的活性位点残基(碳原子标记为灰色),DFT优化的双模式过渡态TS-1的结构(碳原子标记为橙色)。
为了研究NgnD与底物形成复合物的构象,作者团队对其进行了500 ns的经典分子动力学模拟。作者进一步进行了聚类分析以确定具有代表性的酶构象,进而进行环境微扰的过渡态采样 (EPTSS),从而获得环加成过渡态的集合。过渡态TS-1键长(红色键2,蓝色键3)在气相、水、酶的键长分布如图3所示。这些结果表明,环境介质对过渡态分子中形成键的长度分布没有显著影响。
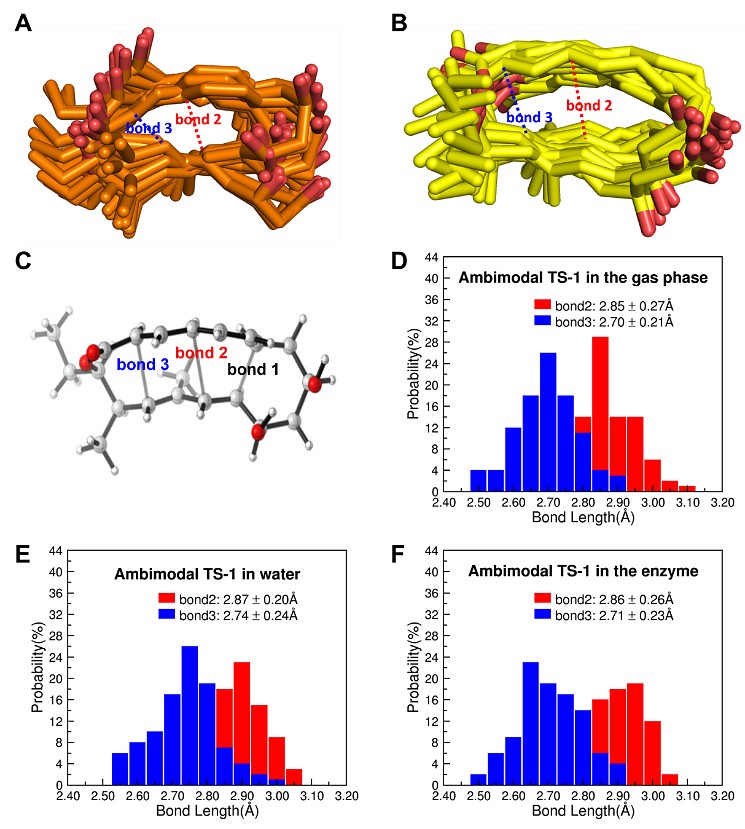
图3. A) 双模式过渡态TS-1和B)反应物分子的集合。C) DFT优化的双模式过渡态TS-1。D) - F) 分别为在气相、水相和酶相中过渡态TS-1几何结构中化学键2和化学键3的分布情况。
基于采样的过渡态,作者团队在气相、水相和NgnD酶中各进行了100条分子动力学轨线模拟,酶中的典型产物生成轨迹如图4所示。结果发现,与气相相比,水和酶缩短了化学键2/化学键3与化学键1形成的时间间隔。时间间隙的缩短可能是由于活性位点残基的疏水或碰撞效应,从而加速了化学键的形成。
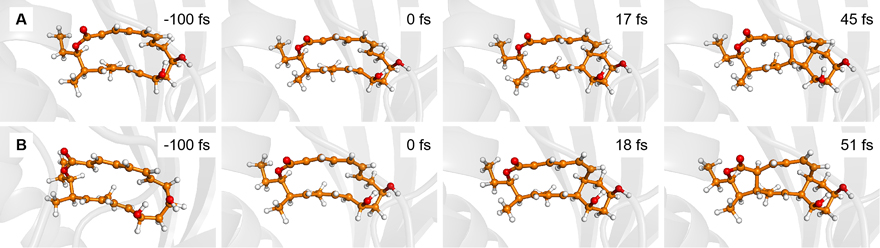
图4. A) 酶中[4+2]产物和B) [6+4]产物生成的典型轨迹。
图5显示了[6+4]产物(蓝色)和[4+2]产物(红色)的PTSB轨迹的分布。[6+4]与[4+2]产物的比值结果如下:在气相中为3.1,水中为5.9,酶中为0.9。值得注意的是,导致PTSB选择性不同的物理因素已经被提出,包括过渡结构的几何形状,过渡态动量分布,势能面的形状,动力学能量分布。在NgnD催化的[6+4]/[4+2]反应中,作者团队建立了一个回归模型来描述过渡态键长与产物比例之间的定量关系。该模型表明:1) 过渡态中较短长度的形成键会优先成键从而生成主要产物;2) 相似长度的形成键本质上导致相似的产物选择性。根据该模型,可以预测[6+4]产物比[4+2]产物生成的更多,预测结果在所有介质中均具有可比性。然而,[6+4]/[4+2]产物在气相、水和酶中的比例有显著差异。因此,不同介质中选择性的变化不太可能受到过渡结构几何形状的控制。相反,反应分子和附近环境之间的动态相互作用可能影响了产物比例。这些动态相互作用可能以碰撞或接触的形式发生,从而扰动反应过程中化合物的动量。
为了验证计算的预测结果,作者团队进行了实验,实验结果表明,[6+4]/[4+2]产物的比例平均为6.6,近似水环境中介质效应的计算预测趋势符合实验观察。这一趋势表明,[6+4]产物在水中比在酶中更容易生成。

图5. 在A)气相、B)水和C)酶中反应轨迹的分布情况。


图6. [6+4]和[4+2]产物在体内酶反应和非酶反应中的紫外分析。
作者团队研究了[6+4]产物在水相中生成比例更高的原因。为了研究极性效应,作者团队使用水(介电常数为78.5)和乙醚溶剂(介电常数为4.2)进行了隐式溶剂模拟。如图7所示,由双模式过渡态TS-1进行的反应轨迹模拟[6+4]/[4+2]产物比例在水中为8.6,在乙醚中为5.0,说明[6+4]产物在极性更强的环境中更受青睐。计算得知[6+4]产物的偶极矩为6.6 D,而[4+2]产物的偶极矩为5.9 D。因此,在极性溶剂中,[6+4]产物较大的偶极矩可以更好稳定存在,从而在极性较大的环境中[6+4]产物可以得到更多。
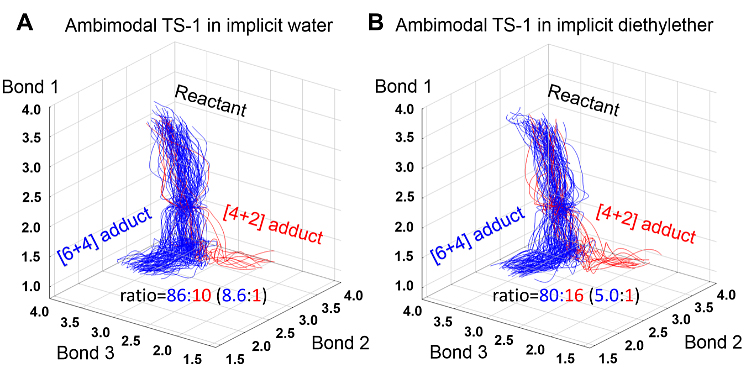
图7. 在A)隐式水和B)隐式乙醚中,反应轨迹的分布情况。
最后,作者团队计算了每个产物的分子体积。相比于过渡态分子体积,[6+4]产物体积收缩约1%,[4+2]产物体积收缩约3%。这表明[6+4]产物与显式水分子发生更多的碰撞。作者团队还进行了溶剂可及表面积(solvent accessible surface area, SASA) 的计算,发现SASA的差异与体积变化一致。虽然大小差异很小,但当周围环境中有其它物质可以与底物相互作用时,后过渡态分叉反应会更倾向于生成一个体积较小的分子即[4+2]产物,因此酶会降低[6+4]产物生成的百分比。
结论
作者团队通过理论计算和实验验证相结合,系统地研究了介质环境对NgnD催化的过渡态后分叉生成[6+4]和[4+2]产物的影响。从极性和分子体积的角度进一步探索了后过渡态分叉反应的特性,本研究将激发人们探索使用后过渡态分叉反应来调控选择性的新策略。
这一成果近期发表在Journal of the American Chemical Society 上,文章的第一作者是南京大学2017级博士汪欣,现为河南大学特聘教授。江南大学的张纯副研究员为本文共同第一作者。范德堡大学(Vanderbilt University)的博士后姜姚昱坤为本工作提供了非常重要的帮助。南京大学的梁勇教授、戈惠明教授和美国范德堡大学的Zhongyue Yang教授为本文的通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Influence of Water and Enzyme on the Post-Transition State Bifurcation of NgnD-Catalyzed Ambimodal [6+4]/[4+2] Cycloaddition
Xin Wang, Chun Zhang, Yaoyukun Jiang, Wen Wang, Yuan Zhou, Yu Chen, Bo Zhang, Ren Xiang Tan, Hui Ming Ge*, Zhongyue J. Yang*, and Yong Liang*
J. Am. Chem. Soc., 2021, 143, 21003–21009, DOI: 10.1021/jacs.1c10760
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号