雷晓光团队Nat. Catal.:自然界中首例exo选择性分子间Diels-Alder反应酶
药物中间体、农药、精细化学品在国计民生中占据重要地位,传统的化学合成工艺存在效率低和污染严重等瓶颈问题;基于酶催化的生物合成工艺,具有过程绿色、选择性好等优势,目前得到了广泛的应用,特别是在创新药物的工业化生产中。然而,目前酶催化反应的工具箱还非常有限,能够催化新颖化学转化的酶亟待被发现,从而推动酶催化在工业上的更广泛应用,帮助实现化学品的“碳中和”绿色生物制造。
狄尔斯-阿尔德反应(Diels-Alder reaction,简称D-A反应)是共轭双烯(二烯体)与取代烯烃(亲二烯体)之间发生的[4+2]环加成反应,是合成化学中构建C-C键最常用的方法之一,已经在天然产物全合成、药物分子工业化生产以及材料化学等方面得到了广泛的应用。2021年诺贝尔化学奖授予的有机小分子催化所应用的第一个实例即为不对称D-A反应。为了实现某一个非对映异构体的高效合成,D-A反应过程中的区域、endo/exo以及对映立体选择性必须得到精准控制(图1a)。传统化学催化的D-A反应存在着立体选择性差、合成效率低等问题,因此从自然界中挖掘和利用立体专一性的D-A反应酶受到了化学家们的广泛关注和研究[1]。虽然目前已有一些高立体选择性D-A反应酶的报道,但它们一般催化的是分子内D-A反应,且往往仅能产生单一的endo构型产物,而合成应用价值更高的exo选择性的分子间D-A反应酶非常少见,极大限制了D-A反应酶在化学合成中的应用。
近日,北京大学化学与分子工程学院、北大-清华生命科学联合中心雷晓光实验室与美国加州大学洛杉矶分校(UCLA)化学系Ken N. Houk实验室合作,在Nature Catalysis 杂志在线发表研究论文,报道了自然界中催化不同endo/exo选择性Diels-Alder反应的酶,利用这两类酶实现了一系列D-A产物的高效精准合成,并解析了这两类不同endo/exo选择性D-A反应酶的催化机制,为后续D-A反应酶的开发和在药物合成上的工业化应用奠定了基础。

桑科植物中广泛存在着结构多样的D-A类型天然产物,其中一些天然产物具有相同的二烯体和亲二烯体结构单元,但其endo/exo构型完全相反,例如chalcomoracin (1) 和mongolicin F (4),如图1b所示。而在前期的研究中,雷晓光课题组及合作者在白桑愈伤组织中鉴定到首个催化分子间D-A反应的单功能D-A反应酶MaDA,并证明了其催化的分子间D-A反应具有优异的对映立体和endo选择性,可以用于chalcomoracin (1)、guangsangon E (2) 以及artonin I等endo类型天然产物的高效不对称合成(Nat. Chem., 2020, 12, 620, 点击阅读详细;Biotechnol. J., 2020, 15, 2000119)。然而MaDA并不能催化产生任何exo构型的天然产物(例如mongolicin F(4) 以及guangsangon J (5)),这暗示着桑科植物中还存在着exo选择性的D-A反应酶,而该酶很有可能就是MaDA的同家族蛋白。
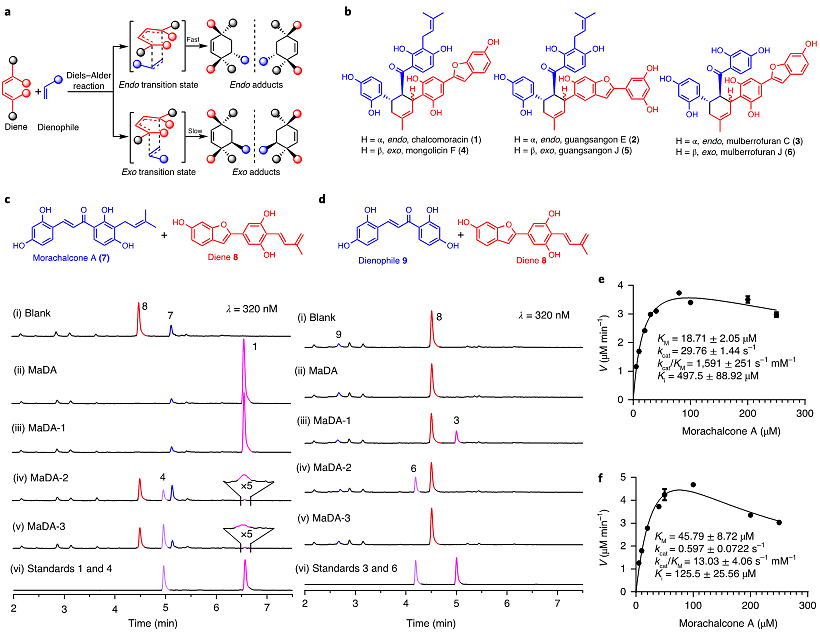
图1. 桑科植物中D-A反应酶的发现与表征
通过生物信息学分析,作者在川桑基因组中共找到41个与MaDA同源的基因,其中有8个基因与MaDA进化关系最近。随后在白桑基因组中对其中三个基因(MaDA-1、MaDA-2、MaDA-3)进行了扩增,并利用昆虫表达体系对这三个基因进行外源表达与纯化。酶活测试结果显示MaDA-1也可以催化morachalcone A (7) 与二烯体(8)之间的D-A反应,专一性生成endo构型天然产物chalcomoracin(图1c);而MaDA-2和MaDA-3主要催化exo选择性的分子间D-A反应生成mongolicin F,其中MaDA-3(exo/endo = 40:1)比MaDA-2(exo/endo = 13:1)具有更高的exo选择性(图1c)。当使用不带异戊烯基的查尔酮9作为底物时,MaDA和MaDA-3不能检测到对应D-A产物的生成,而MaDA-1和MaDA-2可以分别催化endo以及exo选择性D-A反应的发生生成对应的天然产物mulberrofuran C和J(图1d)。随后作者也对新发现的endo选择性D-A反应酶MaDA-1以及exo选择性D-A反应酶MaDA-3进行了酶学性质表征。与endo选择性D-A反应酶MaDA-1(kcat/KM = 1591 ± 251 mM-1•s-1)相比,exo选择性D-A反应酶MaDA-3反应效率更低(kcat/KM = 13.23 ± 4.12 mM-1•s-1)(图1e和1f)。
为了进一步证实MaDA-1和MaDA-2/3具有不同的endo/exo选择性,作者利用MaDA-1和MaDA-2/3作为催化剂实现了一系列D-A类型天然产物的化学酶法合成,通过将酶学产物与天然产物进行比对,证明了MaDA-1的产物均为endo构型的天然产物,而MaDA-2/3的主要产物均为exo构型的天然产物(图2),随后通过手性HPLC分析又证实了这些酶学产物均为光学纯产物(ee值 > 99%)。这些实验结果证明了MaDA-1和MaDA-2/3具有一定的底物宽泛性、良好的endo/exo选择性以及优异的对映立体选择性,在D-A产物的高效精准合成上具有潜在的应用价值。
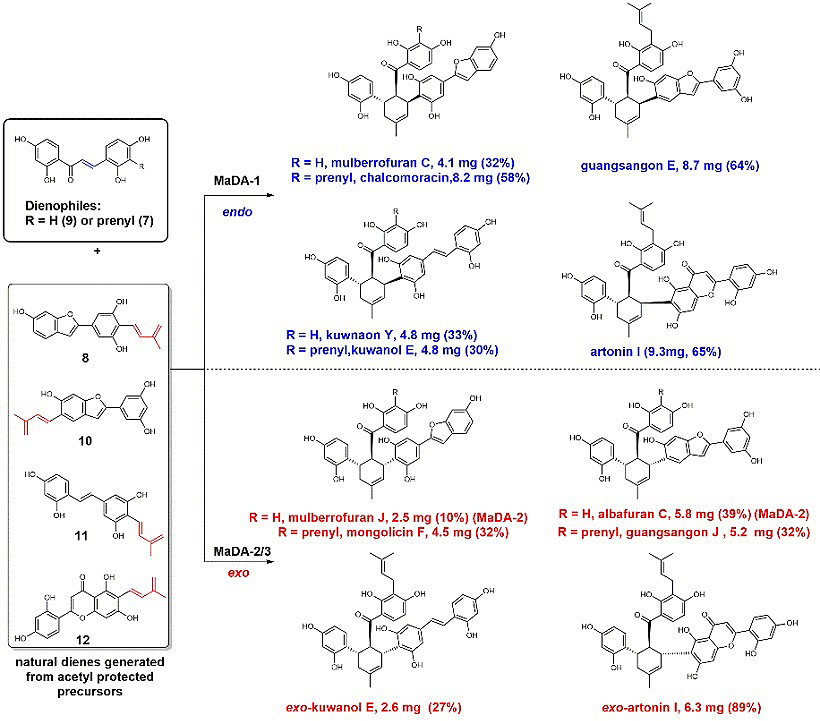
图2. 桑科植物中D-A类型天然产物的化学-酶法合成
为了进一步探究这类D-A反应酶在合成中的应用价值,作者合成并测试了大量非天然的二烯体,发现这类D-A反应酶所能识别的最小二烯体结构单元为二烯体13。在化合物13的烯基邻位进一步引入羟基后得到化合物14,MaDA-1和MaDA-3对该化合物的转化率明显提高,可以以69%和61%的收率得到光学纯的D-A产物endo-26和exo-26(图3a);在化合物13的烯基对位引入一些大体积取代基时(例如苯酚、苯氧基、苯胺基、杂环化合物等),这类二烯体的转化率也有所提高;然而在化合物13的烯基间位或邻位引入大取代基时,这类二烯体并不能被MaDA-1和MaDA-3所识别并转化。
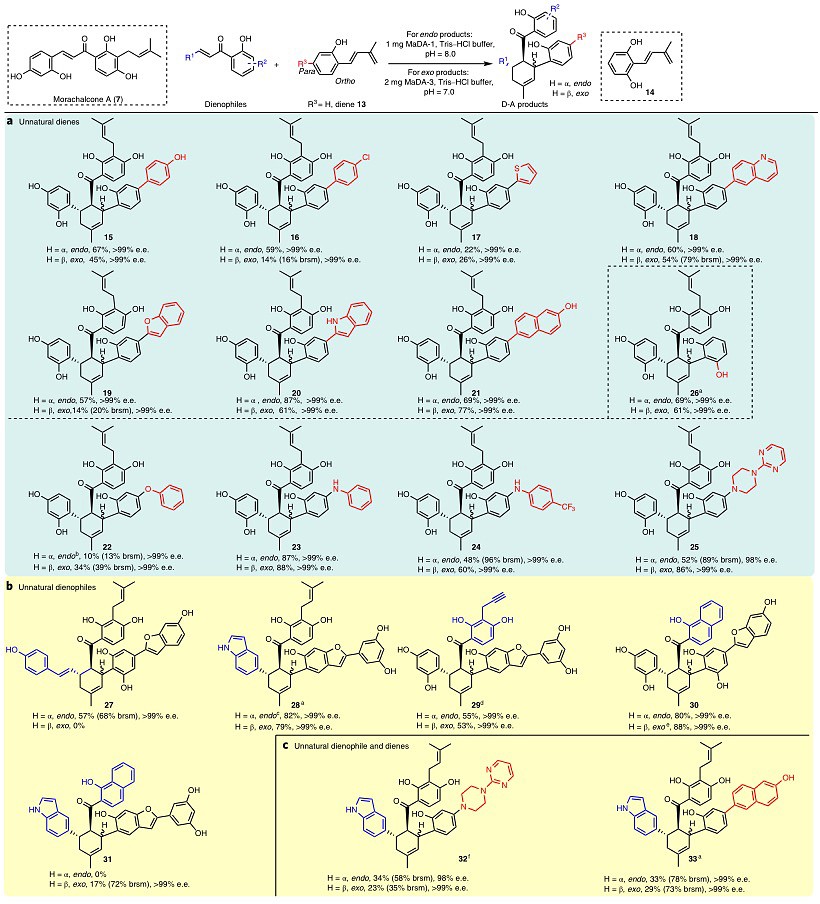
图3. D-A类型产物的高效酶法合成
有了这些初步构效关系信息,作者设计和合成了更多在对位有取代基的化合物13的衍生物,并以morachalcone A (7) 作为亲二烯体进行了毫克级的酶催化反应。作者发现,除了endo-17以及endo-22外,MaDA-1催化的 endo选择性D-A反应的收率大部分在中等以上(48-87%);而对于MaDA-3催化的exo选择性D-A反应,除了exo-16和exo-19的收率相对较低外,其余产物的收率与MaDA-1催化的endo产物的收率大致相当。随后,作者测定了酶促D-A产物的ee值,发现MaDA-1和MaDA-3催化的D-A反应均具有优异的对应立体选择性,除endo-25外(ee 98%),其余所有产物的ee值均大于99%,这进一步证实了这类D-A反应酶具有良好的立体选择性(图3a)。
作者还合成了12个不同的非天然亲二烯体,并测定了这些非天然亲二烯体与天然二烯体8或10之间的酶促反应转化率。随后选取转化率较高的底物进行了毫克级酶促反应,并对反应产物进行了纯化与表征,如图3b所示。此外,作者发现这类D-A反应酶还能立体专一性地催化非天然亲二烯体与非天然二烯体之间的D-A反应生成D-A产物32和33(图3c)。这些结果充分证实了MaDA-1和MaDA-3具有很高的底物耐受性以及立体专一性,在D-A产物的精准高效合成上具有一定的应用价值。
为了探究这类D-A反应酶如何控制反应过程中的endo/exo选择性,作者首先解析了exo选择性D-A反应酶MaDA-3的晶体结构(图4a)。通过仔细比对endo选择性D-A反应酶MaDA与MaDA-3的晶体结构,在二者的底物结合口袋共发现了12个有差异的氨基酸残基(图4b)。作者将MaDA-3中的这12个残基分别突变成MaDA中对应的残基,并评估了这些单点突变对于MaDA-3选择性的影响。结果显示所有的突变均会降低exo活性从而降低MaDA-3的exo选择性。有意思的是,R294G的单突变还会显著增加MaDA-3的 endo活性,使得MaDA-3的exo选择性从40:1下降到3.8:1,是12个位点中对于exo选择性影响最大的位点(图4c)。在R294G突变的基础上再引入两个相邻位点的突变(I292F, L296R)会进一步降低MaDA-3的总催化活性,所得的MaDA-3-Mu3蛋白基本丧失了exo选择性(exo/endo = 1:1);在MaDA-3-Mu3的基础上再引入两个突变(F314I, T316S)后,所得到突变体MaDA-3-Mu5展示出了一定的endo选择性(exo/endo = 1:2),如图4c所示。
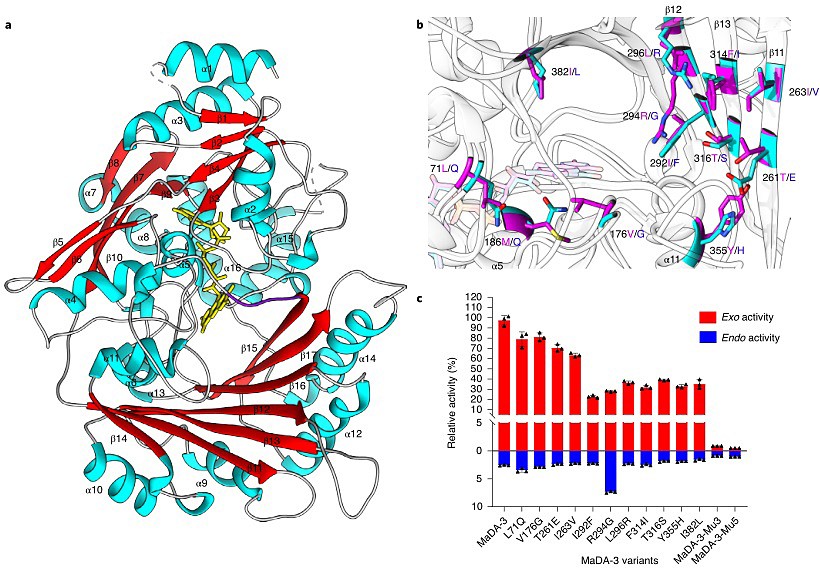
图4. MaDA-3的晶体结构以及基于结构的突变实验
随后作者还通过计算模拟以及突变实验进一步探究了endo选择性D-A反应酶MaDA的催化机制。在MaDA与endo过渡态TS1(endo)的结合模型中,Y412、E414以及R443形成了氢键相互作用网络,并通过R443与亲二烯体之间形成氢键来活化亲二烯体。此外,亲二烯体还可以与S316和Y194形成氢键相互作用,而二烯体可以与F375形成很强的π-π相互作用(图5a)。对以上位点进行突变后,除Y412F突变体外,其余突变均会造成MaDA活性的显著下降(图5b),这也说明了Y412与E414之间的氢键相互作用对于MaDA活性的影响并不大。作者还通过分子动力学模拟对endo过渡态TS1(endo)与MaDA的结合稳定性进行了研究。如图5c所示,TS1(endo)能够较稳定的结合在FAD所在的MaDA底物结合空腔内,而exo过渡态TS1(exo)并不能稳定结合在该空腔内。

图5. 基于计算模拟和突变实验的D-A反应酶催化机制解析
利用同样的策略,作者对exo选择性D-A反应酶MaDA-3也进行了机制解析。exo过渡态TS1(exo)在MaDA-3中结合模式与TS1(endo)在MaDA中的结合模式很相似,但亲二烯体整体上更靠近FAD。MaDA中观察到的Y412/E414/R443氢键网络在MaDA-3中被R294/E414/R443所替代。此时MaDA-3中R443不再能与亲二烯体形成氢键相互作用,而R294可以与亲二烯体形成cation-π相互作用从而催化exo选择性D-A反应的发生(图5d和5e)。除此之外,MaDA-3中的F375也能二烯体形成较强的π-π相互作用,而T316也可以通过氢键相互作用提高MaDA-3的活性(图5d和5e)。分子动力学模拟计算也进一步证实TS1(exo)可以比较稳定地结合在MaDA-3的催化口袋中,而TS1(endo)则不能稳定结合到MaDA-1中(图5f)。
最后,作者利用DFT theozyme calculation的方式建立了MaDA以及MaDA-3的theozyme 模型。在MaDA催化的endo选择性D-A反应中,R443通过与亲二烯体形成氢键相互作用可以使的该反应的活化能从22.2降低至20.3。而在MaDA-3催化的exo选择性D-A反应中,R294通过与亲二烯体的苯环形成cation-π相互作用,可以将该反应的活化能从23.7降低至20.8。因此也较好的解释了两种不同endo/exo选择性D-A反应酶在催化机制上的差异(图6)。
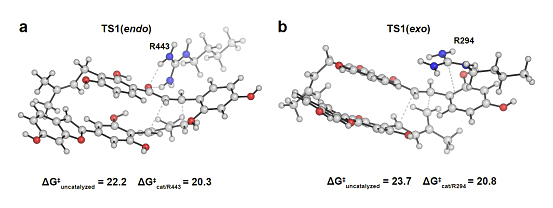
图6. 两种不同选择性D-A反应酶的DFT theozyme calculation。
小结
北京大学雷晓光课题组以及UCLA的K. N. Houk课题组合作报道了两种不同功能的FAD依赖蛋白,它们催化了不同endo/exo选择性D-A反应的发生,并证实了这类D-A反应酶具有良好的底物适用性以及立体选择性,在D-A产物的精准高效合成上具有重要的价值。此外,基于结构生物学、计算化学以及突变实验,雷晓光课题组及Houk课题组还解析了不同选择性D-A反应酶的催化机制,证明了endo类型D-A反应酶主要是通过R443与亲二烯体形成氢键来促进D-A反应的发生;而exo类型D-A反应酶主要通过R294与亲二烯体形成cation-π相互作用来促进反应的发生(图7)。
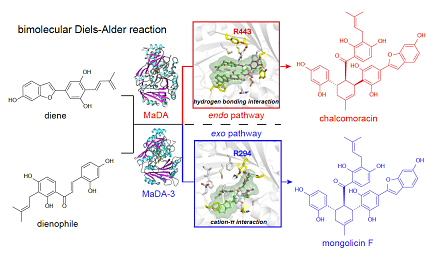
图7. 全文总结
在该工作中,雷晓光课题组特聘副研究员高磊博士,K. N. Houk课题组博士后邹一可博士,雷晓光课题组博士后刘小晶博士和博士研究生杨军为共同第一作者。雷晓光教授以及加州大学洛杉矶分校的K. N. Houk教授为共同通讯作者。雷晓光课题组特聘副研究员范俊萍博士以及博士后杜晓霞博士在晶体结构解析方面做出了重要贡献。雷晓光课题组的博士研究生王进、于欣水也在底物合成以及基因扩增方面提供了帮助。K. N. Houk课题组的Jiang Mingxuan以及Li Yuli也在DFT calculation上提供了帮助。该工作得到国家自然科学基金,国家科技部重点研究发展计划,北京市“卓越青年科学家计划”,北京分子科学国家研究中心,北大-清华生命科学联合中心等多个国家重大科研项目和研究机构的资助。同时也特别感谢瑞士诺华制药公司对雷晓光课题组酶催化研究的资助与深入科研合作。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enzymatic control of endo- and exo-stereoselective Diels–Alder reactions with broad substrate scope
Lei Gao, Yike Zou, Xiaojing Liu, Jun Yang, Xiaoxia Du, Jin Wang, Xinshui Yu, Junping Fan, Mingxuan Jiang, Yuli Li, K. N. Houk & Xiaoguang Lei
Nat. Catal., 2021, DOI: 10.1038/s41929-021-00717-8
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号