蝴蝶分子:全合成的“破茧成蝶”
大自然经过亿万年的更替演变,一直在推进从简单到复杂、从无序到有序、从无为到致用的各种神奇诞生,天然产物就是其中之一。如同蝴蝶般展翅飞翔的洋腊梅碱(1),就是大自然创造出的精美结构:4个连续手性中心、2个相邻季碳中心C-3a(sp3)‒C-3a'(sp3),高度的张力与紧凑的结构,令她美丽而又充满合成挑战(图1)。
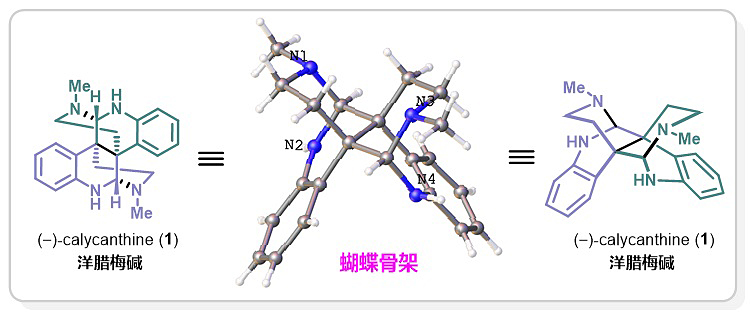
图1. 蝴蝶结构:洋腊梅碱
1888年,洋腊梅碱(1)首次由加拿大西蒙菲莎大学Eccles博士从C.glaucus Willd.(粉绿蜡梅,又名美国蜡梅)的种子中分离获得,拉开了色胺二聚类生物碱研究的序幕;1954年,牛津大学化学家Robinson和他的学生Teuber推测其可能存在五种分子异构形式1-5;1960年,哈佛大学化学家Woodward通过降解产物推导确定了真实存在的形式为结构1;同年,英国伯明翰大学Hamor教授又通过其二氢溴代二水合物的单晶衍射加以确证。这五种分子都含有4个N原子、6个交错环、2个相邻全碳季碳手性中心,独特的分子结构和良好的生物活性受到合成化学家们广泛的关注。其中1、2、3、5四个结构已经被分离鉴定,骨架4直到去年才被加州大学洛杉矶分校的Garg教授通过全合成及提取分离证实了明确的存在。合成方面的报道,山腊梅碱骨架3的研究最为集中,分子结构中的相邻季碳被争相作为突破季碳构筑方法的“磨刀石”。受到仿生途径从色胺和色氨酸衍生物氧化二聚的启发,绝大多数研究小组都以色胺、色氨酸或氧化吲哚作为起始原料开展合成。尽管这些结构吸引了大批合成化学家不断建立新策略去突破,异洋腊梅碱(2)的研究却鲜有报道(图2)。
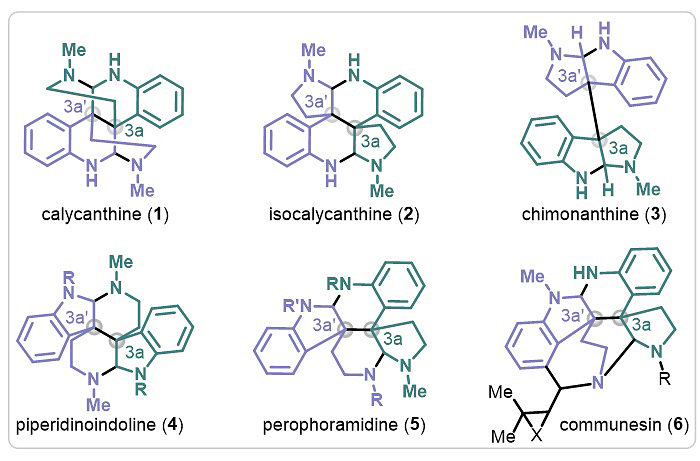
图2. 4N型二聚类生物碱
华东师范大学姜雪峰(点击查看介绍)课题组基于生物碱多样性合成的理念 (Angew. Chem. Int. Ed., 2015, 54, 14960; J. Am. Chem. Soc., 2016, 138, 5218; Angew. Chem. Int. Ed., 2018, 57, 9028; J. Am. Chem. Soc., 2021, 143, 1334),基于“烯胺化学的氨基酸手性诱导建立天然产物”的理念(Chem. Commun., 2014, 50, 9690; Org. Lett., 2017, 19, 3167; Org. Lett., 2018, 20, 292),设计合成了一系列苯胺与烯胺共轭的2N底物7,原因有三:1)色氨酸底物以烯胺结构启动反应时,首先要突破芳构化能量,导致反应条件剧烈,官能团兼容性差;2)色氨酸底物手性源处于柔性侧链的远端,手性控制诱导性低、可控性差;3)原料7便于合成,芳胺与烯胺一步Suzuki偶联即可获得(图3)。基于对色胺化学和烯胺化学的对比思考,二聚环色胺类生物碱(1-5)和communesin(6)家族(图1中由紫色和绿色分割表示)可以被看作是两个烯胺7的二聚(1-3)、两个色胺的二聚(4)以及烯胺7与色胺的交叉二聚(5-6)。不同于前人选用色胺、色氨酸和氧化吲哚作为起始原料,该课题组从自主设计合成的易得原料7出发,挑战一步二聚构筑相邻全碳季碳手性骨架的策略,可以突破4N型二聚类生物碱多样性集成式全合成。

图3. 姜雪峰课题组的合成策略
表观上看,异洋腊梅碱(2)可以由底物7经氧化偶联一步二聚形成连续的三根新化学键(C8a–N8'、C3a–C3a' 和C8a'–N8)所得。逆合成分析可见,二聚体8是关键中间体,可经手性酯基脱除和保护基转化获得异洋腊梅碱(2),其中的相邻季碳C3a–C3a' 键可以认为是由“双边锁定”的十元环中间体Int-2中的两个叔碳自由基偶联构筑。底物7中富电子的苯胺可被铁催化单电子氧化,通过手性酯基诱导从位阻较小的一侧发生两次分子间自由基加成(TS-1),从而构建两根C-N键(C8a–N8' 和 C8a'–N8)形成中心自由基偶联所必须的“双锁扣”骨架(图4)。

图4. 异洋腊梅碱(2)的逆合成分析
作者对铁催化剂和氧化剂进行了系统的探究。结果发现,空气条件下,三氟甲烷磺酸铁Fe(OTf)3作催化剂,过氧化双月桂酰(LPO)作氧化剂,氯仿作为溶剂(c = 0.01),可以48%的收率得到目标二聚产物8j。随后,作者通过简单更换芳基硼试剂和烯胺前体高效建立了16个异洋腊梅碱(2)的分子骨架库,其中二聚体的绝对构型由8i的晶体确定。
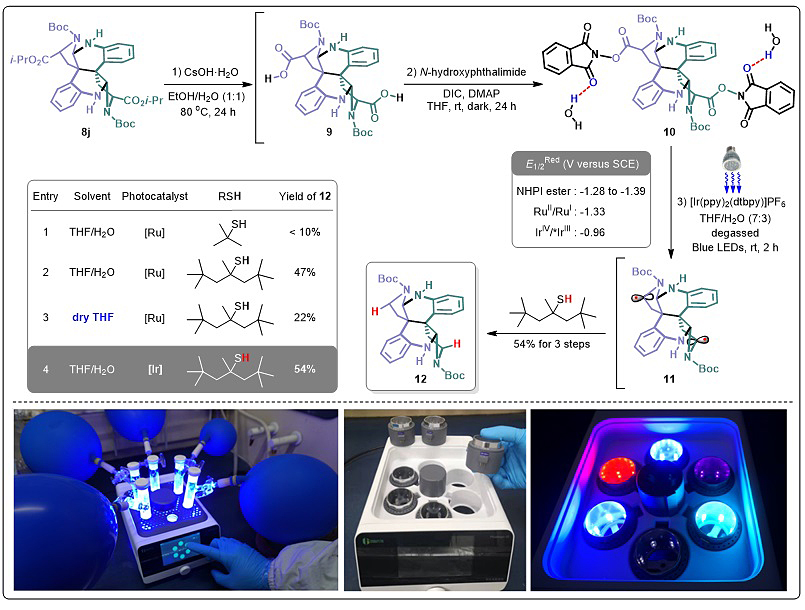
图5. 自主研发的光反应器Photosyn‒10高效实现双脱羧氢化筛选
进一步,二聚体8j被用来完成异洋腊梅碱(2)的全合成:经强碱氢氧化铯双水解,但而后的许多直接或间接的脱羧方法尝试均未成功,包括Barton、Baran、MacMillan、Movassaghi、Okada和Overman的方法。最后发现只有Okada-Overman脱羧条件才能勉强分离到少量脱羧产物,即将水解粗品经N, N'-二异丙基碳二亚胺(DIC)缩合原位制备活性邻苯二甲酰亚胺(NHPI)酯,在电子牺牲剂i-Pr2NEt和光敏剂Ru(bpy)3Cl2·6H2O (II) 催化蓝光照射下还原脱羧,所得双碳自由基被叔丁基硫醇(t-BuSH)淬灭,最终以小于10%的收率分离得到脱羧产物12。猜测叔丁基硫自由基对反应体系的干扰,将之替换为位阻更大的叔十二硫醇(tert-dodecylthiol)后,反应效率显著提升为47%。更有趣的是,反应体系如果不加水,收率会降到22%;而若将光敏剂换为[Ir(ppy)2(dtbpy)]PF6,反应效率会提升到54%。从金属还原电势角度分析可解释这一明显差别,在水与NHPI酯形成氢键的帮助下,较温和的Ir(III)比Ru(II)/i-Pr2NEt原位生成的Ru(I)更适合还原氢键复合物10 (E1/2Red V vs. SCE: IrIV/Ir*III= -0.96, RuII/RuI= -1.33, NHPI ester = -1.28 to -1.39)(图5)。
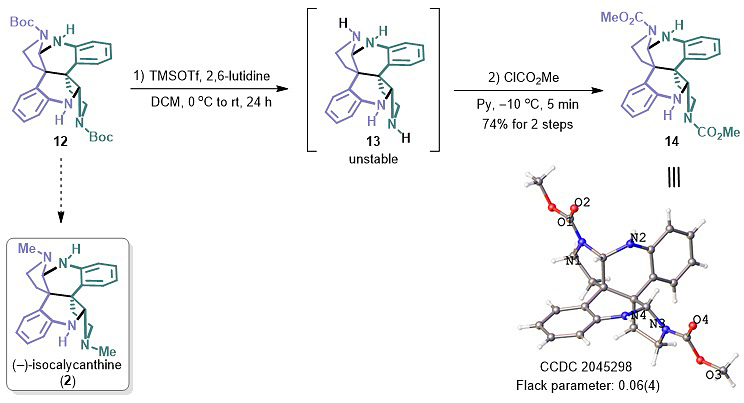
图6. 异洋腊梅碱(2)的合成探索
从脱羧产物12到异洋腊梅碱(2)的各种尝试(包括直接还原Boc为Me和脱Boc后上Me)均不能实现。之后,较易被还原的CO2Me被考虑来替代大位阻较难被还原的Boc,系列实验探索发现4N裸露的化合物13并不能稳定分离,只有当吡啶作为溶剂时,能以两步74%的收率获得还原前体14,其绝对构型也被晶体结构进一步确定(图6)。
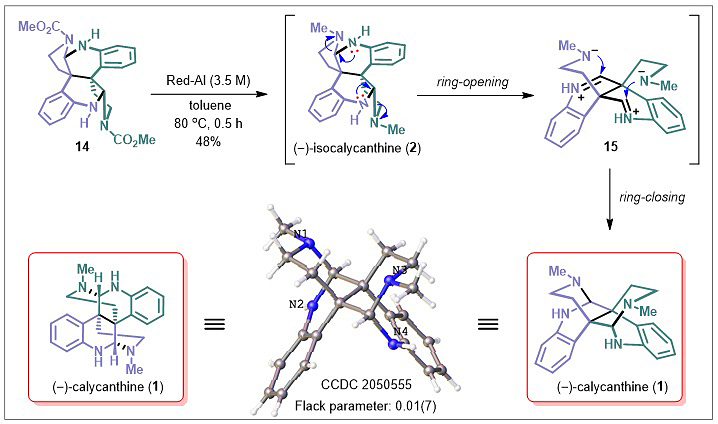
图7. 蝴蝶分子—洋腊梅碱(1)的全合成
从甲酯到甲基的还原过程,还原剂成了核心角色。出人意料的是,各种还原试剂如四氢铝锂(LiAlH4)、二异丁基氢化铝锂(DIBAL-H)和还原性铝(Red-Al),只有Red-Al才能得到一个主要产物,鉴定后发现是洋腊梅碱(1),并没有检测到异洋腊梅碱(2),绝对构型也由晶体进一步确认。原因是:在还原条件下,异洋腊梅碱(2)在其自身骨架张力驱动下发生了开环,所得亚胺再次被胺捕获,骨架重排关环得到张力释放后的具有蝴蝶骨架的洋腊梅碱(1)(图7)。
小结
姜雪峰课题组运用方便易得的烯胺作为起始原料,通过方法学突破,一步二聚化构建了系列异洋腊梅碱库,四个连续手性中心,其中两个连续季碳中心,整个过程犹如破茧成蝶,某种意义上进一步启示我们4N型二聚类生物碱的生物合成途径应该还有更多的可能。
该工作于近期发表于《美国化学会志》(J. Am. Chem. Soc.)上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total Synthesis of (‒)-Calycanthine via Iron-Catalyzed Stereoselective Oxidative Dimerization
Leiyang Bai, Yinhao Ma, and Xuefeng Jiang*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c10498
导师介绍
姜雪峰
https://www.x-mol.com/groups/Jiang_Xuefeng
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号