科研资讯 | Front. Immunol. 烟酸受体与肠道菌群互作参与调控肠道屏障

来源:领研网论文频道
科研
资讯
Frontiers in Immunology
吉林大学动物医学学院研究者联合广东省微生物研究所(华南应用微生物国家重点实验室)研究团队科研人员共同发现,肠道菌群与宿主烟酸受体 GPR109A 互作、调控肠道屏障,其介导的互作机制对肠道菌群均一性和多样性产生了重要的影响。
本研究还发现通过粪菌移植可以对实验性败血症的发展起到保护作用。相关成果发表在国际期刊 Frontiers in Immunology [IF:7.561] 上。
文章全文免费阅读及下载链接,见本文末。
在全球强致死性疾病,败血症的发病过程中可能会出现由细菌,病毒或真菌感染导致的炎症反应,进而通过革兰氏阴性菌分泌的脂多糖(LPS)与宿主免疫系统互作诱发系统性炎症反应和器官衰竭以及坏死,最终导致死亡。
败血症发生的一个重要特征是肠道炎症反应和肠道上皮细胞通透性增加,从而导致革兰氏阴性菌进入宿主的循环系统。肠道炎症反应会激活一系列肠道免疫反应,例如G-蛋白偶联受体的活化。
研究发现,肠道炎症反应活化多种 G蛋白偶联受体,并且参与降低肠道炎症反应以及免疫应激,例如,GPR30、GPR43、GPR109A 等。GPR109A 是介导烟酸、丁酸、羟基丁酸等物质生物学效应的重要受体,近年来发现其与配体结合后,具有抗动脉粥样硬化、降血脂、抗炎、抗肿瘤等生物功能,被视为很多疾病治疗的新靶点。
前期研究发现 GPR109A作为丁酸钠的重要受体,能够保护小鼠抵抗 TNBS 诱导的肠道炎症反应。而在GPR109A 敲除的小鼠中,丁酸钠无法发挥其保护作用。丁酸钠作为肠道微生物的重要代谢产物,对维持宿主肠道上皮细胞的紧密连接和通透性起到重要作用,此外,维持适当浓度的丁酸钠对维持肠道微生态的稳定性和多样性也不容忽视。
作为维持肠道健康,降低肠道炎症反应的重要受体,GPR109A 是否与肠道微生物的多样性、稳定性和代谢产物变化存在联系仍然未知。
在本项研究中,来自吉林大学动物医学学院的科研人员利用 WT 和 GPR109A 敲除的小鼠,结合盲肠结扎穿刺技术建立败血症动物模型,研究发现敲除鼠与野生鼠相比,具有更严重的炎症程度和更高的致死率,且敲除鼠的肠道机械屏障与化学屏障功能都被削弱了。
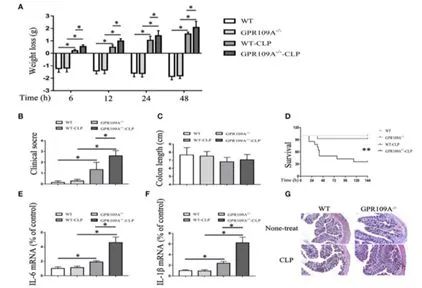
图 1 GPR109A 敲除增加败血症小鼠模型死亡率
那么,GPR109A 敲除是否对肠道微生物也产生了影响,进而对降低宿主抵抗肠道炎症反应的能力呢?吉林大学的研究人员通过和广东省微生物研究所(华南应用微生物国家重点实验室)的科研人员合作,利用16S rDNA 测序技术和生物信息学分析,结果发现,野生鼠与敲除鼠在肠道菌群组成及其代谢信号通路存在显著差异,其中野生鼠拟杆菌门和放线菌门含量高于敲除鼠,而敲除鼠厚壁菌门、变形菌门(多数致病菌属变形菌门)和疣微菌门含量高于野生鼠。
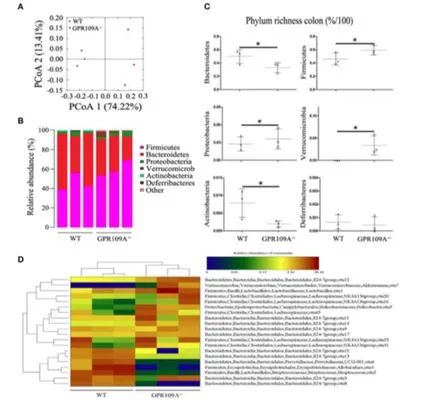
图 2 GPR109A 敲除诱导肠道菌群紊乱
为进一步证实肠道菌在败血症模型中的作用,研究者通过抗生素处理和粪菌移植重建肠道微环境,进一步证实肠道微生物参与了败血症发生过程中发挥了对肠道屏障的保护作用。此研究是世界首例首次利用小鼠模型建立了 GPR109A 受体与肠道菌群之间的直接联系,并且,为肠道菌群分菌移植治疗肠道炎症反应提供了理论和实践依据。

图 3 粪菌移植重建肠道微环境

作者及课题组简介
该文章的第一完成单位为吉林大学动物医学学院,柳巨雄教授、王玮副教授多年来一直从事G蛋白偶联受体相关研究,先后证实了 GPR109A 介导的神经保护、抑制肠道炎症和调控肠道机械屏障的作用。
本研究合作单位广东微生物研究所(华南应用微生物国家重点实验室)谢黎炜研究员及其课题组,通过深度分析和挖掘细菌16S rDNA 测序数据,进一步证实了宿主的基因型对肠道菌群的影响,为宿主-肠道菌互作理论提供了坚实的证据,也为败血症等疾病的治疗和预防提供了有益的思路。
Frontiers 总部位于瑞士,是全球领先的开放获取(Open Access)出版商,致力于使科学在全球范围内更加开放。欲了解更多详情,欢迎访问 Frontiers 官方网站:www.frontiersin.org.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号