天津大学仰大勇团队JACS:DNA水凝胶网络实现T细胞高效捕获和免疫治疗
近期,天津大学化工学院仰大勇教授(点击查看介绍)团队在Journal of the American Chemical Society 上发表关于DNA生物功能材料用于免疫治疗的最新进展。这一研究工作面向肿瘤免疫治疗的应用需求,致力于突破肿瘤浸润T细胞分离提纯的技术瓶颈,通过DNA材料精准化学的精巧设计,为肿瘤免疫治疗探索了一条新的途径。天津大学化工学院姚池副教授和硕士研究生朱晨旭(现在中山大学博士生)为共同第一作者。研究得到国家自然科学基金等资助支持。
基于肿瘤浸润T细胞的免疫疗法近年来在临床试验中取得了突破性进展。这一疗法中的T细胞不需要基因工程改造,但依赖于高纯度、高活性T细胞的分离提取。现有的细胞分离方法,例如流式分选法、免疫磁珠法等,存在样本污染、剪切力损伤细胞和依赖大型仪器等问题,获取高纯度低损伤的T细胞仍然存在挑战。脱氧核糖核酸(DNA)是一种生物大分子,具有分子精准可编程和生物相容性好等特点,特别是利用DNA适配体可以实现对目标细胞的特异性识别和分离。仰大勇教授团队在前期工作中开发了一种基于物理交联的DNA水凝胶网络,实现了从骨髓细胞中高效无损分离含量极低的间充质干细胞(J. Am. Chem. Soc., 2020, 142, 3422; Nat. Protoc., 2021, DOI: 10.1038/s41596-021-00621-2)。
在新的研究中,团队通过DNA序列的精巧设计,构建了含有多种功能模块的DNA网络,包括1)适配体模块:识别和捕获T细胞,同时封闭免疫检查点;2)CpG寡核苷酸模块:激活抗原呈递细胞,增强免疫效果;3)互补序列模块:介导DNA网络形成,实现T细胞封装,并提供酶切割位点;4)限制酶模块:响应肿瘤炎症环境,切割DNA网络。这些功能模块序列集成在一条DNA模板链中,通过高效的酶促扩增反应,串联集成在超长DNA单链中,形成DNA水凝胶网络,实现T细胞的高效、特异性和无损分离。获得的T细胞纯度达到98%,存活率达到90%。携带T细胞的DNA水凝胶注射至肿瘤病灶,响应肿瘤炎症环境实现T细胞的释放和激活,对小鼠黑色素瘤的局部免疫治疗效果显著。该研究为分离重要生物颗粒(干细胞、免疫细胞、外泌体等)提供了新的策略,为重大疾病的免疫治疗开拓了新的路径。
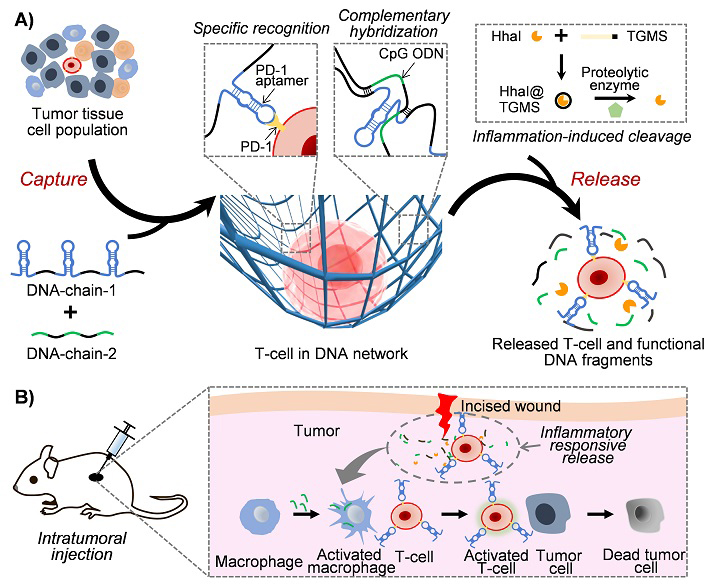
图1. DNA水凝胶网络用于肿瘤浸润T细胞高效捕获和黑色素瘤局部免疫治疗
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

T Lymphocyte-Captured DNA Network for Localized Immunotherapy
Chi Yao, Chenxu Zhu, Jianpu Tang, Junhan Ou, Rui Zhang, and Dayong Yang*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c07036
研究团队简介
仰大勇课题组以生物大分子DNA为研究主线,聚焦DNA生物功能材料化学组装与智能制造,并用于生命分析和疾病治疗。
仰大勇
https://www.x-mol.com/university/faculty/48490
课题组主页
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号