时隔五月,重氮烯烃再上Nature Chem.
重氮烷烃(R1R2C=N2)是一类含氮有机化合物(图1,左)。1883年,Curtius报道了首例重氮烷烃——重氮乙酸乙酯(Ber. Dtsch. Chem. Ges., 1883, 16, 2230–2231)。经过一个多世纪的研究,重氮烷烃作为最重要的合成子之一,被广泛应用于合成化学、化学生物学和材料化学等领域。然而,另一类重要的重氮化合物,即重氮烯烃(R1R2C=C=N2)却极为罕见(图1,右)。事实上,直至1987年,Bott才首次报道了原位形成重氮烯烃,但是无法分离这类反应活性极高的物种(Chem. Ber., 1987, 120, 1867–1871)。
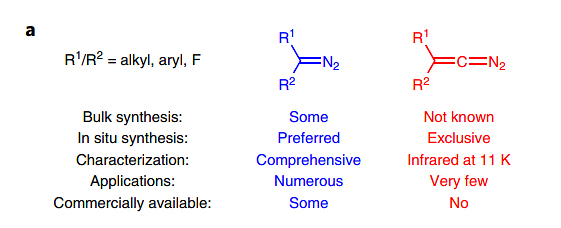
图1. 重氮烷烃和烯烃。图片来源:Nat. Chem.
1988年,理论化学家预测重氮烯烃母体(H2C=C=N2)并非直线型,C-N-N键角为117度。消除氮气的能垒为6.9 kcal/mol,预估在-90 ℃下半衰期为0.3 ms(J. Am. Chem. Soc., 1988, 110, 364–368)。综上,一系列的实验和理论证据表明,重氮烯烃具有极低的热力学稳定性和极高的化学反应性,属于一种“不稳定”的有机官能团。
然而,科学家并没有停止探索重氮烯烃的步伐。今年4月29日,Nature Chemistry 发表了多特蒙德工业大学Max Hansmann教授课题组有关重氮烯烃的相关工作 [1]。他们首次分离表征了室温下稳定的重氮烯烃。时隔五个月后,10月7日,Nature Chemistry 再次刊发了瑞士洛桑联邦理工学院(EPFL)Kay Severin教授课题组重氮烯烃的有关研究 [2]。
为了方便介绍,本文将两个重氮烯烃分别称为“重氮烯烃I”(图2,化合物2)和“重氮烯烃II”(图3,化合物1);合成重氮烯烃的前体分别为介离子氮杂环烯烃(mNHO,图2,化合物1)和氮杂环烯烃(NHO,图3)。
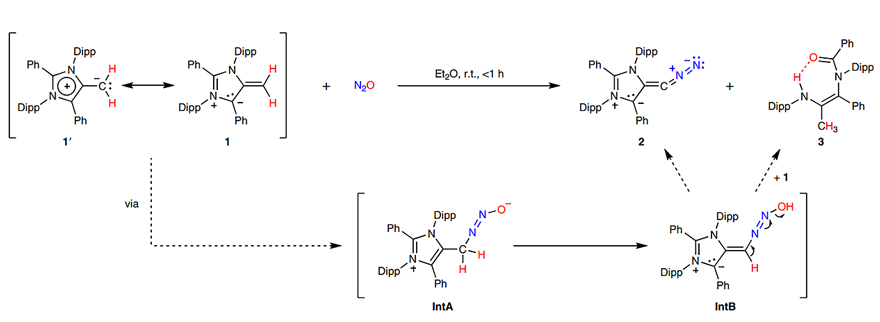
图2.“重氮烯烃I”(化合物2)的合成。图片来源:Nat. Chem.
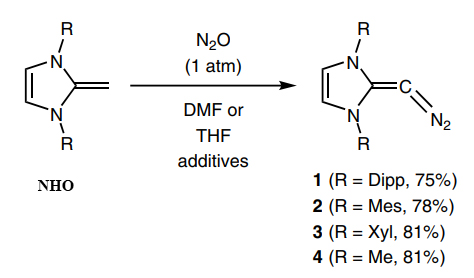
图3.“重氮烯烃II”(化合物1)的合成。图片来源:Nat. Chem.
Hansmann和Severin课题组合成重氮烯烃的方法相同,只需向mNHO和NHO溶液里通入一氧化二氮(N2O)气体即可。反应简单高效地生成了相应的“重氮烯烃I”和“重氮烯烃II”。有趣的是Hansmann教授课题组还成功分离到了其中一个副产物,并推测了该反应的机理(图2)。
Hansmann和Severin课题组运用红外光谱、X-单晶衍射、核磁共振(13C同位素标记)、热重分析(TGA)、高分辨质谱等一系列技术对自己合成的重氮烯烃进行了系统的表征。对于C=N=N结构单元的伸缩振动频率,两篇文章所涉及的重氮烯烃化合物均小于有机重氮化合物(v = 2017–2180 cm–1)和重氮盐(v = 2137–2306 cm–1)。其中,固体“重氮烯烃I”中的频率v = 1944 cm–1 (THF溶液中: v = 1951 cm–1)。这个结果符合这类分子的理论预测,即电子密度集中在C=N=N单元上。
两个课题组都对重氮烯烃的键长键角进行了分析和比较(图4)。“重氮烯烃I”和“重氮烯烃II”均表现出很好的热稳定性,但对紫外光极为敏感。在固体或溶液状态下,“重氮烯烃I”可以在惰性氛围中室温存放几天;而在加热至175 ℃的高温时,TGA显示“重氮烯烃II”的质量几乎没有损失。
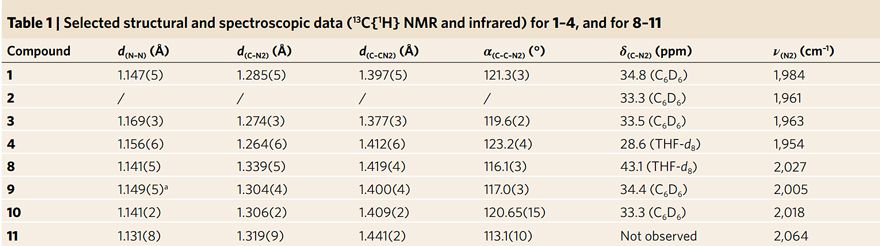
图4. Severin课题组重氮烯烃的测量数据。图片来源:Nat. Chem.
Hansmann课题组对“重氮烯烃I”的共振式进行了详细分析(图5)。他们探讨了2s与一系列相关重氮烯烃的结构及其解离氮气的能量变化(图6, a-c)。如果重氮烯烃的取代基为吸电性或电中性基团,当失去氮气后,形成的亚乙烯基(vinylidene)倾向于单线态(ES/T= −40 ~ −30 kcal/mol,图6d, C)。而供电性基团的亚乙烯基倾向于三线态(图6d, D)。通过CASSCF和NEVPT2理论计算确定2s失去氮气后的亚乙烯基为三线态(其中NEVPT2理论计算显示该亚乙烯基的最低单线态为开壳层单线态,其能量比三线态的高15.2 kcal/mol,本质上二者电子构型相同;而闭壳层单线态亚乙烯基的能量比三线态的高21.1 kcal/mol),该三线态亚乙烯基的一个单电子离域在烯基一侧的氮杂环中。上述研究表明供电子性的氮杂环对2s的稳定性起到关键作用。
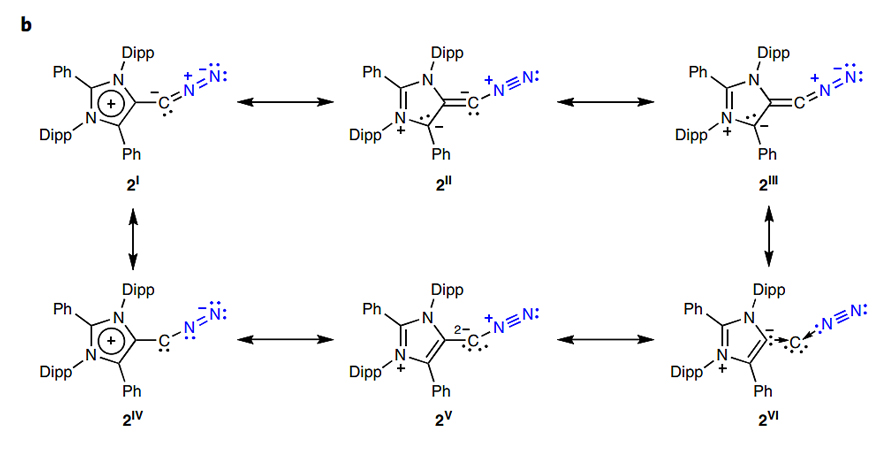
图5.“重氮烯烃I”的共振式。图片来源:Nat. Chem.
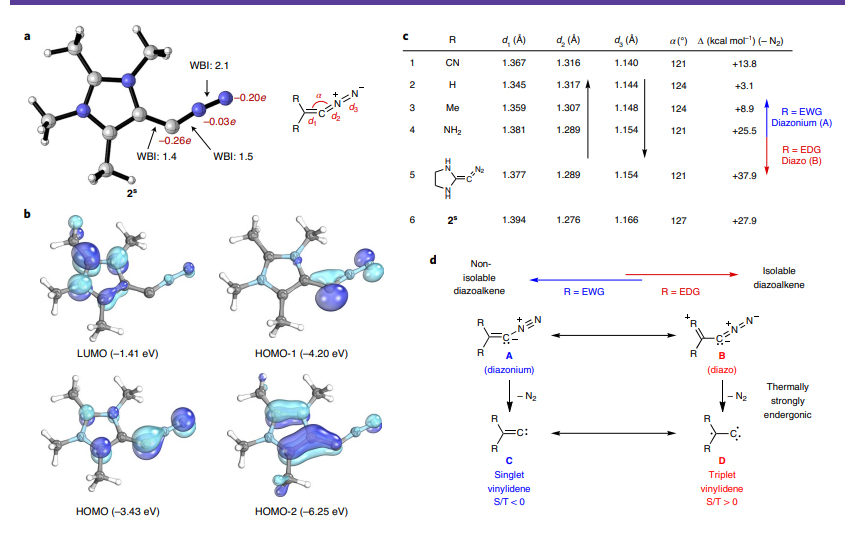
图6.“重氮烯烃I”的理论分析。图片来源:Nat. Chem.
Severin课题组对“重氮烯烃II”的共振式进行了讨论,并进行了相应的理论研究(图7)。在M06-2X/6-311+G(d,p)方法下优化的结构与晶体结构吻合较好,较大的单线态与三线态能级差(ΔEST = 45.5 kcal/mol)符合“重氮烯烃II”在实验中表现出的抗磁性。前线轨道分析显示,HOMO和HOMO-1在中心碳原子出现最大的轨道系数。HOMO为π型轨道,HOMO-1为σ型轨道。这两个最高占据轨道表明“重氮烯烃II”的中心碳原子表现出特殊零价碳的性质(中心碳被两个配位键稳定并含有两对孤电子),该重氮烯烃中心碳原子具有强的配位性质,这对它后续的反应性有重要的影响。
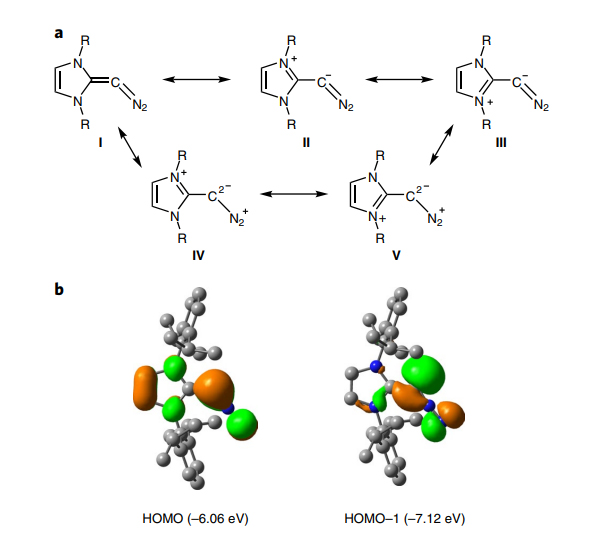
图7.“重氮烯烃II”的共振式及其前线分子轨道。图片来源:Nat. Chem.
重氮化合物极容易失去一分子氮气,在有机合成中常作为卡宾前体。重氮烯烃也不例外,在光解的条件下,失去氮气后生成相应的高活性亚乙烯基中间体,与相邻的化学键发生插入反应(图8和图9)。
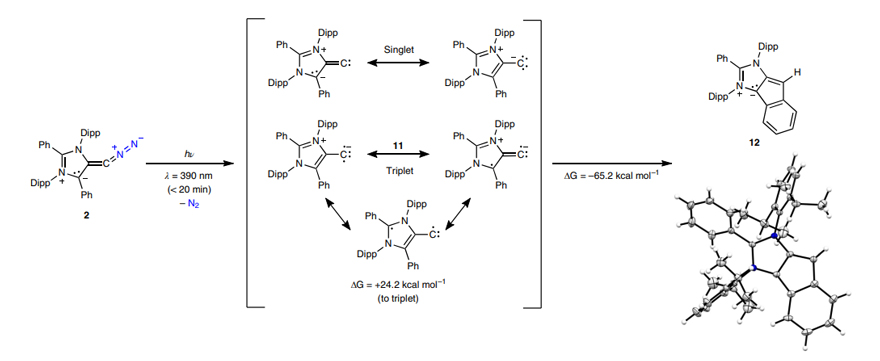
图8.“重氮烯烃I”的光解工作。图片来源:Nat. Chem.
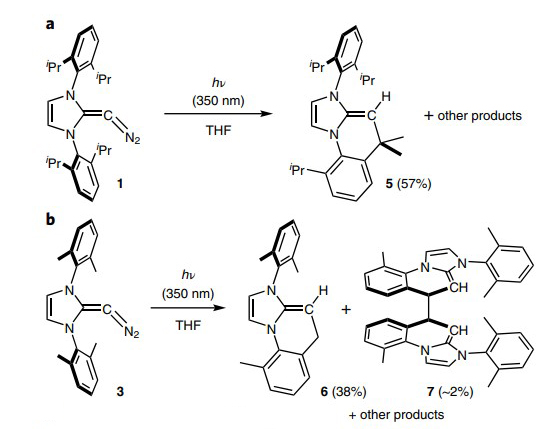
图9.“重氮烯烃II”的光解反应。图片来源:Nat. Chem.
随后两个课题组探究了重氮烯烃的反应性。“重氮烯烃I”与路易斯酸B(C6F5)3的反应在乙醚和甲苯中分别生成了两种配位模式的产物,表明了“重氮烯烃I”具有双配位模式(即烯基C与重氮N都表现出路易斯碱性),且该配位作用均没有导致氮气的解离(图10);“重氮烯烃I”与金配合物(Me2S)AuCl反应则生成了偶氮桥连的产物。
“重氮烯烃II”与(Me2S)AuCl反应则生成了中心碳与金配位的产物,且“重氮烯烃II”与一价铑[RhCl(CO)2]2、二价钯[PdCl(C3H5)]2、三价铝AlCl3的反应均生成了类似的中心碳与金属配位的产物(图11);这一实验结果与“重氮烯烃II”前线轨道分析的反应性吻合较好,该重氮烯烃的中心碳原子有较强的配位能力。此外,“重氮烯烃II”可以与多种不饱和试剂(比如二硫化碳CS2、马来酰亚胺、丁炔二酸二甲酯及四氰基乙烯)进行环加成反应(图12)。
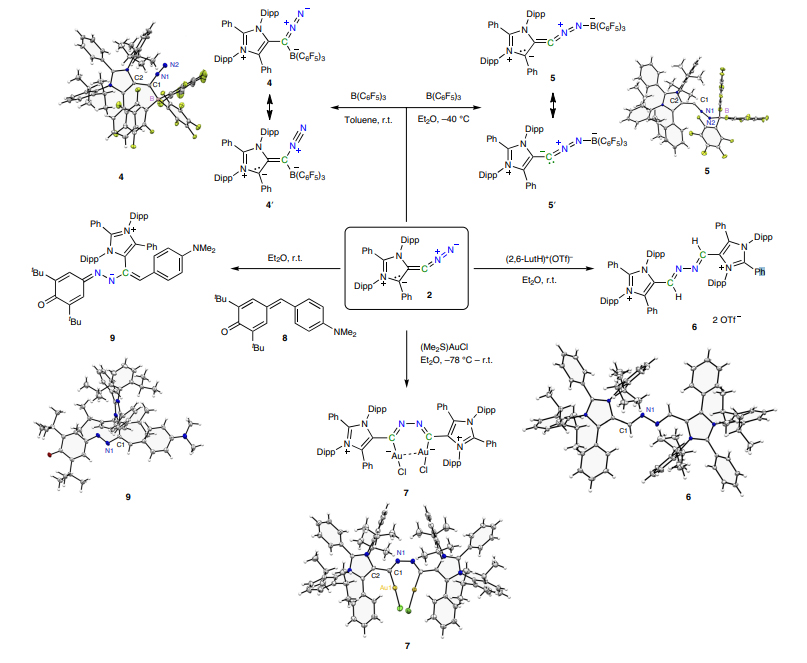
图10.“重氮烯烃I”的反应性。图片来源:Nat. Chem.
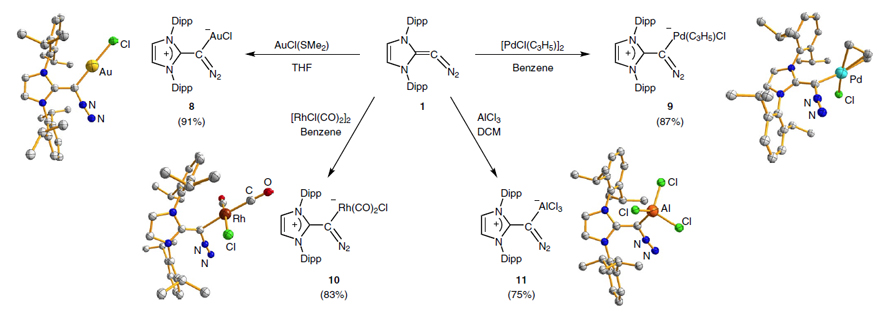
图11.“重氮烯烃II”与金属的配位反应。图片来源:Nat. Chem.
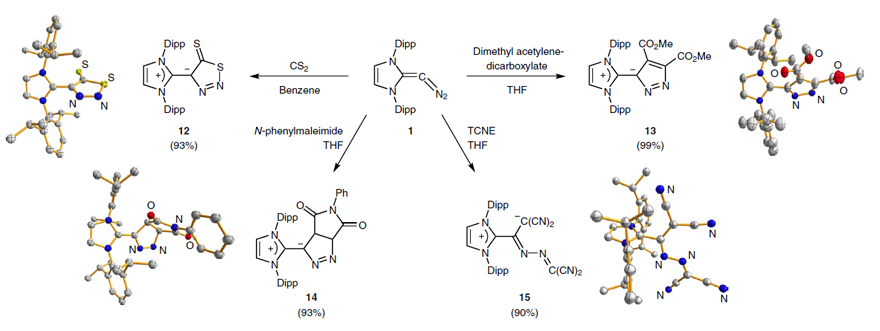
图12.“重氮烯烃II”与不饱和化合物的反应。图片来源:Nat. Chem.
至此,笔者简要介绍了Hansmann和Severin教授课题组对两种氮杂环烯烃与N2O反应生成重氮烯烃的研究。合适的取代基(氮杂环卡宾或氮杂环介离子卡宾取代基)可以稳定重氮烯烃官能团。有机化学发展至今,挖掘各类官能团的新颖性质仍然是研究热点。然而,发展新型有机官能团极具挑战性。上述工作将开启重氮烯烃在合成化学中的应用。事实上,Hansmann近期又报道了重氮烯烃转变为其他官能团的报道(J. Am. Chem. Soc., 2021, 143, 12878–12885)。然而,合成含有一般取代基团的重氮烯烃或重元素取代的重氮烯烃(E=C=N2)仍充满挑战,期待更多优秀的工作被报道。
1. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Isolation and reactivity of an elusive diazoalkene
P. W. Antoni, C. Golz, J. J. Holstein, D. A. Pantazis & M. M. Hansmann
Nat. Chem., 2021, 13, 587–593, DOI: 10.1038/s41557-021-00675-5
2. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Isolation and characterization of diazoolefins
Paul Varava, Zhaowen Dong, Rosario Scopelliti, Farzaneh Fadaei-Tirani & Kay Severin
Nat. Chem., 2021, 13, 1055–1060, DOI: 10.1038/s41557-021-00790-3
(本文由LLL_SUSTech供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!









































 京公网安备 11010802027423号
京公网安备 11010802027423号