挑战导向的线粒体双重损伤协同抗肿瘤纳米制剂
传统的、基于单一机制的抗肿瘤策略(放疗、化疗等)往往存在毒副作用、有限的治疗窗口等问题,这凸显了发展多途径、尤其是具有协同效应的抗肿瘤策略的重要性和紧迫性[1]。以时间-空间可控的方式、以对肿瘤细胞的存活和增殖必不可少的关键性亚细胞目标为靶点的多维度协同损伤策略有望解决抗肿瘤应用中长期存在的问题,实现更精准、更高效的抑瘤作用。
光激活抗肿瘤疗法具有治疗部位精准可控、毒副作用小等优点。线粒体是细胞进行能量代谢的主要细胞器,在肿瘤发生发展中起到至关重要的作用;以肿瘤细胞中的线粒体为攻击对象是抗肿瘤治疗的新策略。近日,中国科学院大学化学科学学院田志远教授课题组与中国科学院过程工程研究所马光辉院士、魏炜研究员团队和上海交通大学医学院附属同仁医院王玉刚主任医师团队合作在Nature Communications 在线发表研究论文,该工作立足于光化学反应构建了一种以金属有机框架(Metal-organic frameworks,MOFs)结构为载体、以近红外光作为触发源、以肿瘤细胞内的线粒体作为损伤对象的抗肿瘤纳米制剂。静脉注射后,该纳米制剂借助叶酸组份的靶向作用选择性地富集到肿瘤部位;经近红外光照射,制剂中的上转换颗粒将长波长的近红外光转换为高能量的紫外光并将MOFs结构中的中心金属离子Fe(Ⅲ) 还原成Fe(Ⅱ)、导致MOFs结构的崩解进而将Fe2+释放出来;另一方面,触发光同步催化包埋在MOFs空腔中的光致产酸组份发生光化学反应、导致肿瘤内局部微环境的酸化。Fe2+的原位释放、局部微环境的酸化以及细胞内线粒体高表达的过氧化氢(H2O2)协同促进芬顿反应(Fenton reactions:Fe2++ H2O2 → Fe3+ + •OH + OH−)产生高反应活性的羟基自由基(∙OH),从而对线粒体产生氧化应力(oxidative stress);另一方面,细胞内微环境的酸化诱导钙离子内流和线粒体钙过载(calcium overload)。通过精准时间-空间控制和上述两种机制的协同作用对肿瘤细胞内线粒体进行多层级损伤(multilevel mitochondrial damage),进而实现了高效杀伤肿瘤细胞并抑制肿瘤的生长。
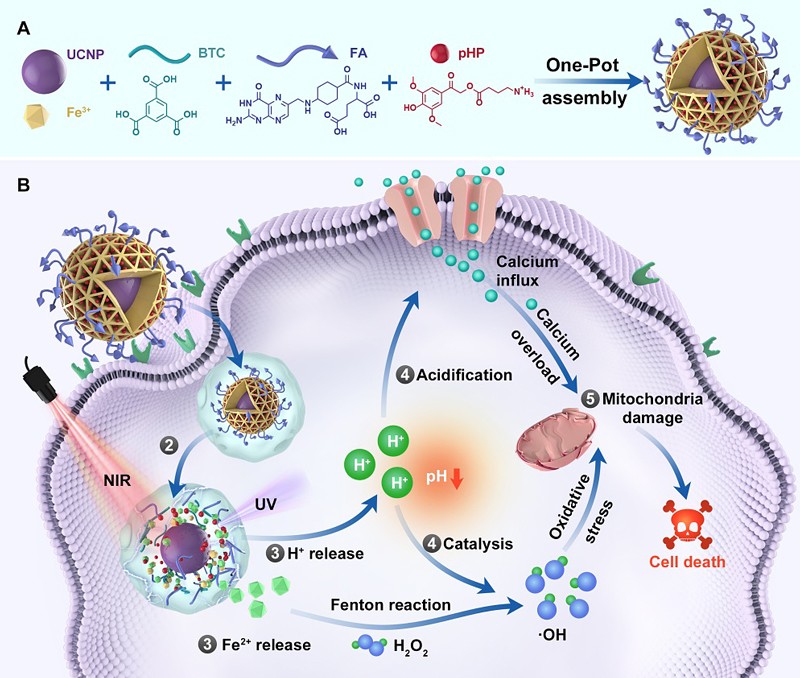
图1. 基于对线粒体双重损伤机制的纳米制剂的构建及其潜在的抗肿瘤机制。
除了通过近红外光触发得以实现精准激活抑瘤作用而无需物理接触、而且能克服紫外和可见光触发所遇到的组织穿透深度问题之外,该抗肿瘤纳米制剂还具有以下几方面的特点:1)叶酸靶向作用和位点特异性组份(H2O2)使得氧化性损伤集中在肿瘤细胞内的线粒体上,2)线粒体上高表达的H2O2、光诱导的Fe2+释放和光酸化三重促进因素协同强化氧化性损伤作用,3)瘤内微环境的光酸化在加强氧化性损伤作用的同时诱导线粒体钙过载,4)同步触发的双重损伤(氧化性损伤和钙过载)均以线粒体为损伤对象、协同诱导线粒体的失能及肿瘤细胞的死亡。在以多种肿瘤细胞为模型的体外实验中,该制剂显示了显著的抑瘤效果。尽管该抗肿瘤制剂尚处于动物水平的临床前研究阶段、其实际临床疗效有待进一步确认,但在临床肝癌患者来源的异种肿瘤移植动物模型的抑瘤实验中,一次该纳米制剂分散剂的注射加上两次980 nm激光器对肿瘤部位的照射即可完全抑制肿瘤的发展,展示了该制剂基于对线粒体的双重损伤机制作为一种安全强效的抗肿瘤制剂的前景。
中国科学院大学化学科学学院博士研究生鲍威尔为该论文的第一作者,田志远教授、马光辉院士、魏炜研究员为共同通讯作者。相关研究工作得到了国家自然科学基金、国家重点研发计划和国家科技重大专项计划的支持。
Nature portfolio平台上也发布了介绍该工作的博客文章:“Challenge-oriented design of nanoagent enabling dual-mitochondrial-damage synergistic antitumor therapy”。[2]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

MOFs-based nanoagent enables dual mitochondrial damage in synergistic antitumor therapy via oxidative stress and calcium overload
Weier Bao, Ming Liu, Jiaqi Meng, Siyuan Liu, Shuang Wang, Rongrong Jia, Yugang Wang, Guanghui Ma, Wei Wei & Zhiyuan Tian
Nat. Commun., 2021, 12, 6399, DOI: 10.1038/s41467-021-26655-4
参考文献:
1. Y. L. Lv, F. Li, S.Wang, G. H. Lu, W. E. Bao, Y. G. Wang, Z. Y. Tian*, W. Wei*, G. H. Ma*, Near-infrared light–triggered platelet arsenal for combined photothermal-immunotherapy against cancer. Sci. Adv., 2021, 7, eabd7614. DOI: 10.1126/sciadv.abd7614
2.Challenge-oriented design of nanoagent enabling dual-mitochondrial-damage synergistic antitumor therapy
研究团队简介
田志远,中国科学院大学化学科学学院教授,博士生导师,中国科学院特聘研究员。1995年7月于武汉大学获得学士学位,2005年7月于中国科学院化学研究所获得博士学位,2005年11月至2011年2月期间分别在加拿大女王大学、美国华盛顿州立大学等从事博士后研究工作,2011年3月入选中国科学院“引进国外杰出人才计划(百人计划)”并就职于中国科学院大学。
研究领域是光化学、光学活性功能材料及其生物应用研究。在相关领域发表SCI论文近70篇,包括以通讯作者身份在Nat. Commun.、Sci. Adv.、JACS、ACS Nano、Anal. Chem.、Acc. Chem. Res.等期刊上发表的文章。参与撰写两本英文合著、一本中文合著。曾获得中国科学院院长优秀奖、中国科学院“百人计划”终期评估优秀奖、宝钢优秀教师奖、李佩优秀教师奖、中国科学院朱李月华优秀教师奖等荣誉。担任SCI学术期刊《物理化学学报》(Acta Physico-Chimica Sinica)期刊编委、中国化学会“分子光子学与激发态化学”专业委员会委员。
田志远
https://www.x-mol.com/university/faculty/23713
马光辉
https://www.x-mol.com/university/faculty/23677
魏炜
https://www.x-mol.com/university/faculty/179231
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号