余金权团队Science:配体控制羧酸导向C-H键活化的脱氢反应
众所周知,在生物系统中,脂肪酸脱氢是生成腺苷-5’-三磷酸(ATP)的关键代谢步骤。事实上,脂肪链脱氢不仅是体内酶(如NADH脱氢酶、琥珀酸脱氢酶等)催化重要的转化反应,而且还是大宗化工和精细化工合成中的一个重要过程。目前,科学家已经开发了各种方法来满足人类对羰基化合物脱氢的合成需求,如硒氧化物和亚砜中间体的syn-消除、其它试剂(如N-叔丁基苯硫腈氯化物、高价碘和 N-氧代铵盐)参与的氧化脱氢、电化学驱动的羰基化合物脱氢等众多方法。羰基化合物脱氢过程最被认可的催化途径是酮先形成Pd(II)烯醇化物,随后通过 β-氢化物消除得到烯酮产物。如图1A所示,Newhouse 小组利用Pd(II)配合物将预先生成的烯二醇锌氧化为 α,β-不饱和酸。然而,要想将合成上十分有用的α-取代羧酸转化为预制备的烯二醇锌却极具困难。因此,开发一种基于亚甲基C-H键活化的高效脱氢方法十分必要。然而,非导向基团底物的C-H键活化脱氢反应存在两大挑战:(1)亚甲基 C-H 键活化困难;(2)烯烃产物中烯基氢的活化很难避免。
在过去的十多年里,美国斯克利普斯研究所(The Scripps Research Institute)的余金权教授(点击查看介绍)课题组长期从事于由天然官能团(如游离羧酸、游离脂肪胺和天然酰胺)导向的配体促进的C-H键活化反应。但是,由天然官能团(如羧酸)导向的非环状脂肪族底物的亚甲基C-H键活化反应仍颇具挑战(图1B)。目前,化学家通过串联链烷烃脱氢-烯烃复分解、自由基途径等策略均没有很好地解决脂肪链脱氢反应问题。受此启发,余金权教授课题组报道了一类吡啶-吡啶酮配体控制Pd(II) 催化的脱氢反应策略,实现了亚甲基或甲基C-H键的活化,从而将多种脂肪族羧酸直接转化为 α,β-不饱和酸或 γ-烷基丁烯内酯(图1C)。实验结果与DFT计算结果均表明:与Pd(II)形成六元螯合物的配体相比,五元螯合物的配体在C(sp2)-H键裂解能力较弱。相关成果于近日发表在Science 上,第一作者为博士生Zhen Wang和博士后Liang Hu。
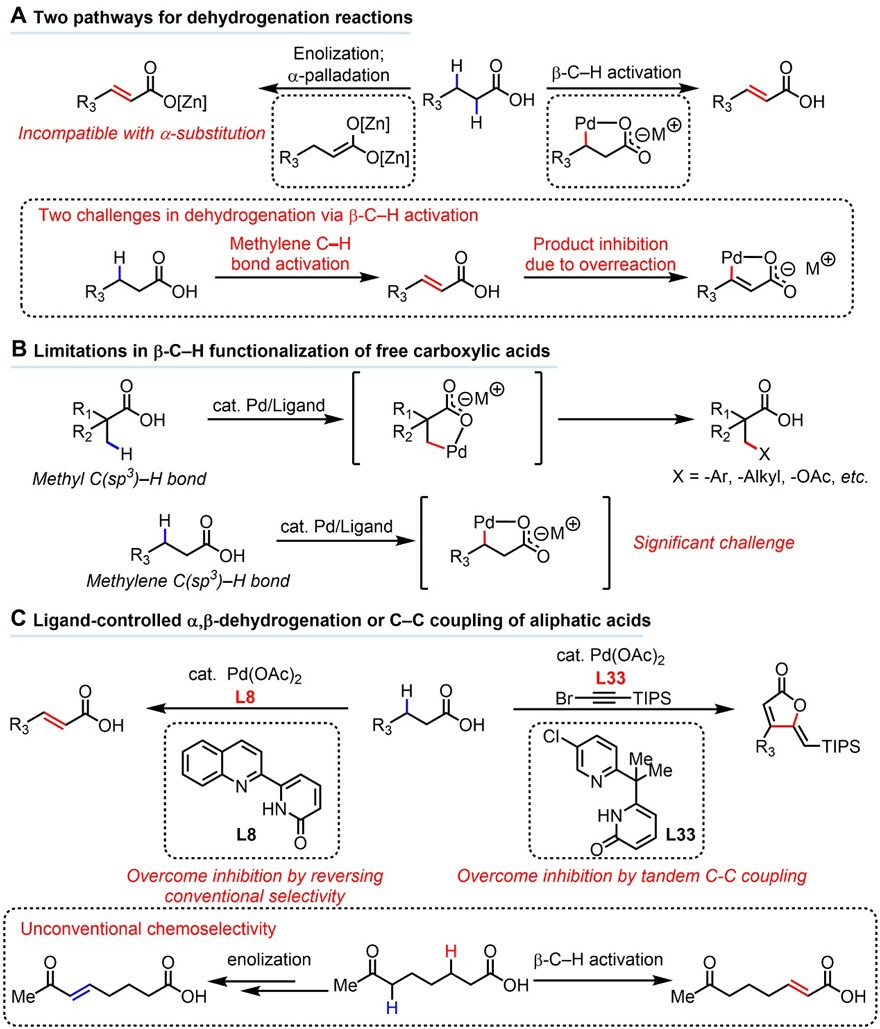
图1. 碳氢活化的脱氢反应。图片来源:Science
先前的研究表明2-吡啶酮可通过配体参与促进Pd(II)催化的C-H键活化,计算研究表明其可作为X-型配体以类似于N-H(乙酰基)部分直接参与C-H键断裂步骤。鉴于乙酰基保护的氨基喹啉(APAQ)类配体已成功用于Wasa酰胺导向的亚甲基 C-H键活化,因此作者以2-吡啶酮取代N-H(乙酰基)部分来设计合成一系列配体,以探索天然游离羧酸导向的亚甲基C-H键活化的反应性。为此,作者选择己酸为模型底物、1,4-二恶烷为溶剂,探索了不同配体的反应性。研究表明:1)与Pd(II)形成六元螯合物的配体(L5-L7)反应性较差,而形成五元螯合物的配体L8则极大地促进了该脱氢反应(产率:71%);2)氢-氘交换实验表明,与Pd(II)形成六元螯合物的双齿吡啶酮配体对2-己烯酸的β-乙烯基C(sp2)-H键有反应性,导致六元螯合配体的反应性较差,而五元螯合配体却与之相反;3)尽管五元和六元螯合配体均可活化C(sp3)-H键,但前者的咬合角(78.7°vs 88.2°)不利于烯烃产物的后续C(sp2)-H键活化,这可能是由于相应的C(sp2)-H键裂解过渡态(TS)中 L8 的结构扭曲增加。进一步的反应条件筛选表明在L8为配体、叔戊醇/1,4-二恶烷为混合溶剂、Pd(OAc)2(4 mol%)为催化剂的条件下,能以81%的分离收率得到目标产物2-己烯酸。
在最优条件下,作者对该反应的底物范围进行了考察(图2),结果显示简单的直链和支链脂肪酸(2a-2f)、含有环体系的羧酸(2g-2k)、含有酰胺基和醚的羧酸(2l-2p)、卤素、甲硫基或NH-Boc取代的苯丙酸(2q-2u)、吡啶(2v)、苯基戊酸(2w)以及α-取代羧酸(2x-2z、2ab-2ad)均可顺利地进行脱氢反应,以中等至较好的产率构建了一系列α,β-不饱和酸。对于同时具有β-甲基和β-亚甲基C-H键的羧酸(2aa)而言,脱氢反应更优先发生在β-亚甲基的C-H键上面。值得注意的是,含有可烯醇化基团(如:羰基(2ae-2ag)、酯基(2ah-2ai))的羧酸底物也能兼容该反应,并且选择性地在羧酸的β-亚甲基C-H键上进行脱氢反应。此外,α-季碳底物1-丙基环己基-1-羧酸也可以顺利在β,γ位脱氢,随后与丙烯酸酯偶联获得复杂的稠合内酯(2aj)。最后,作者发现其它的氧化剂(如:叔丁基过氧化氢(TBHP)、1 atm O2)也可以替代 Ag2CO3,以中等的产率(40-67%)得到所需的α,β-不饱和酸(2a-2d、2q-2s和2ag-2ai),当底物1b以1.0 mmol规格在3 atm O2条件下反应时,能以71%的收率得到脱氢的产物2b。
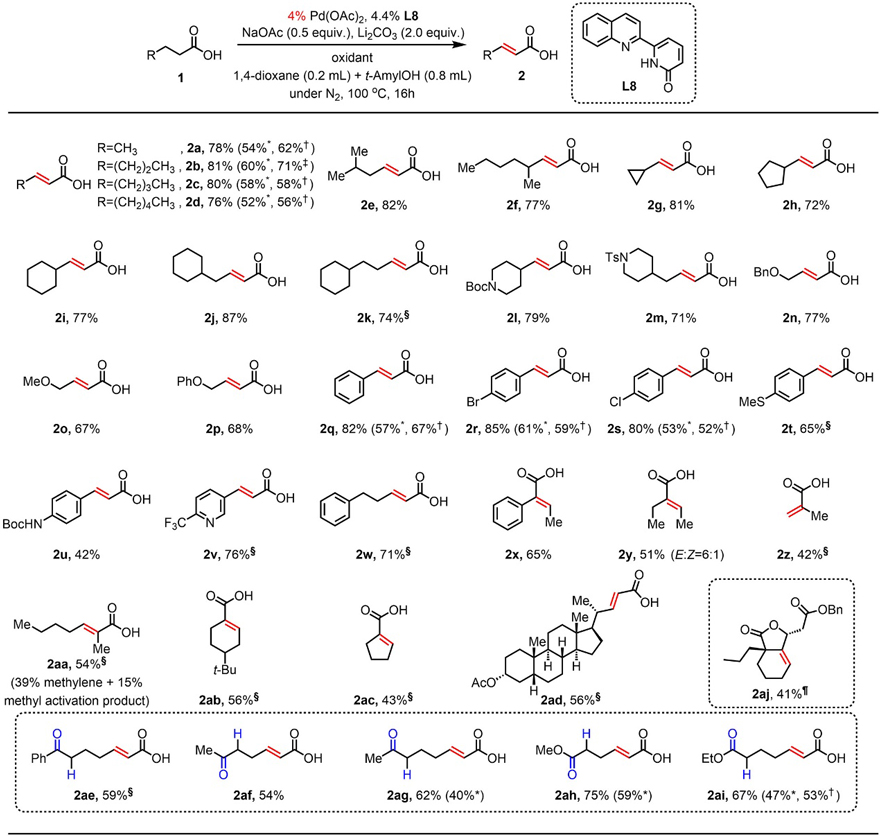
图2. 羧酸脱氢反应的底物拓展。图片来源:Science
虽然五元螯合配体(如L8)可以抑制上述反应中产物C(sp2)-H键的活化,但是作者希望利用六元螯合的配体来拦截乙烯基的C-H键钯化中间体,完成乙烯基羧酸的C(sp2)-H键活化,从而实现C(sp3)-H键和C(sp2)-H键的顺序活化。基于此设想,作者以炔溴与羧酸作为偶联试剂,利用C-H键脱氢-炔基化-环化串联的策略,构建了一系列天然产物以及复杂分子中极为重要的γ-烷基丁烯内酯,实现了C(sp3)-H键和C(sp2)-H键的顺序活化。对配体(L5、L20-L39)的进一步筛选发现带有吸电子取代基(L33和L39)的双齿配体效果较好,分别以68%和57%的产率得到产物5a。正如预期所示,无论如何筛选五元螯合配体(L8)仅得到 α,β-不饱和酸,而不能进一步发生C(sp2)-H键活化得到γ-烷基丁烯内酯产物。毫无疑问,五元和六元螯合配体之间反应性的这种鲜明对比进一步突出了配体咬合角调控了不同的化学反应性。
在最优条件下,作者对串联反应的底物范围进行了考察(图3),结果显示简单的链状脂肪族羧酸均能实现这一转化,以中等至良好的产率提供相应的β-取代γ-烷基丁烯内酯产物(5a-5s)。3-环戊基丙酸(3g)和3-环己基丙酸(3h)的产率较低,这可能是由于它们β-位的空间位阻影响。此外,该反应对稠合丁烯内酯的合成也十分有效,并以中等的产率提供所需产物(5t-5y)。值得注意的是,不同的炔溴也能兼容该反应,从而得到所需的γ-烷基丁烯内酯产物(5z、5aa)。其次,作者以最佳配体L39对β-甲基 C-H 键的支链脂肪族羧酸的底物范围进行了考察,结果显示异丁酸(7a)、2-甲基丁酸 (7b)、烷基(7c-7d)、芳基 (7e-7i)、杂原子(7h-7j)取代的羧酸均能实现脱氢-炔基化-环化串联反应,以中等至较好的产率得到所需产物,特别是该串联反应在多个β-C-H 键的存在下显示出唯一的单选择性。此外,该反应对药物分子(抗哮喘药塞曲司特5ab)和复杂分子(7l和7m)的后期修饰也具有很好的兼容性,从而成功地将丁烯内酯部分引入到复杂的天然产物和药物分子中。最后,作者对γ-亚烷基丁烯内酯5t进行了衍生化研究(图3),例如:1)在TBAF的作用下脱除TIPS保护基得到8(产率:67%);2)碘化脱TIPS,以73%的产率得到乙烯基碘产物9,后者可以进一步衍生化;3)在碱性条件下水解为1,4-二羰基化合物10(产率:66%);4)与肼反应以81%的产率得到哒嗪11。
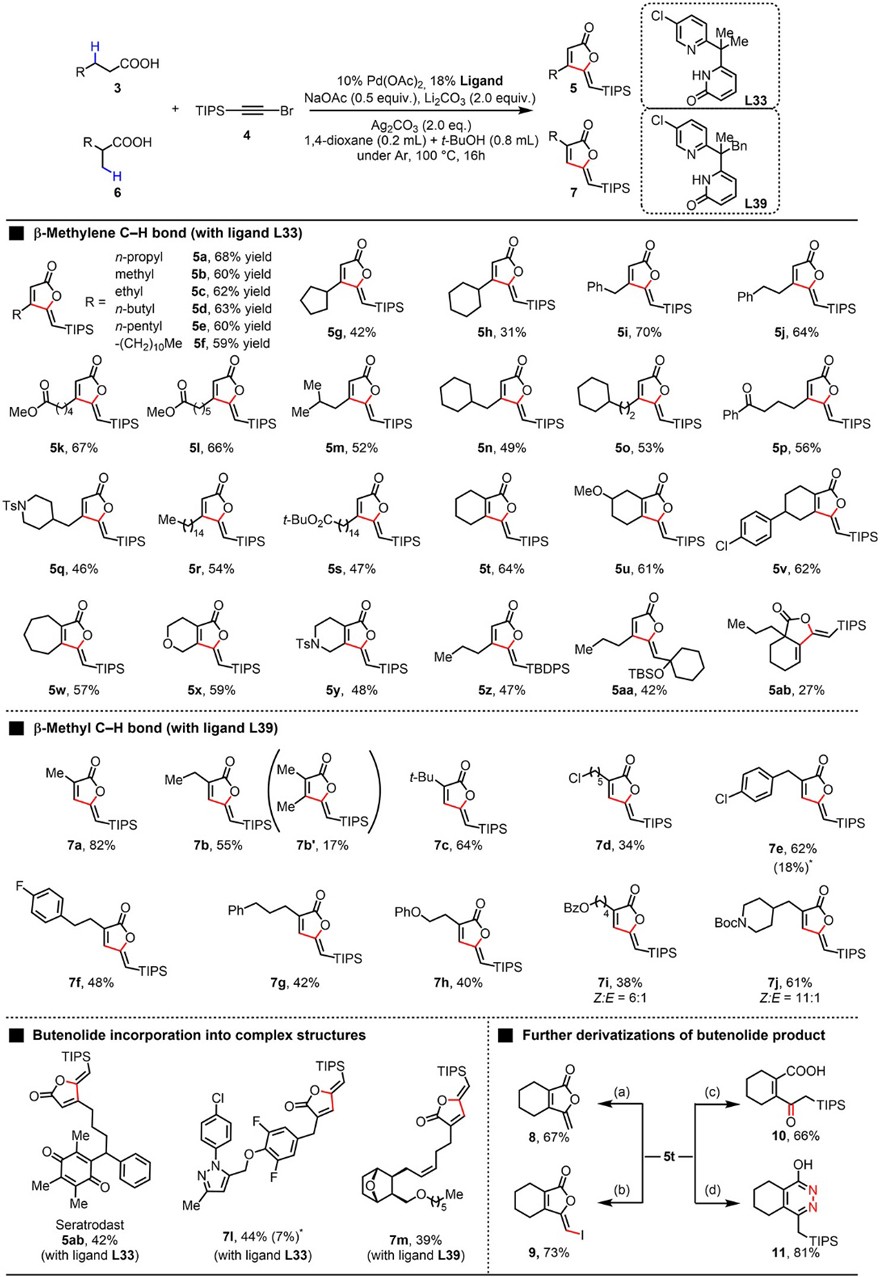
图3. 丁烯内酯构建的底物拓展。图片来源:Science
总结
余金权教授课题组开发了两类不同的吡啶-吡啶酮配体,促进了Pd 催化羧酸的 β-亚甲基 C-H 键活化以进行不同的脱氢反应,简单高效地合成了一系列 α,β-不饱和羧酸或 γ-烷基丁烯内酯。DFT计算与实验结果表明:不同咬合角(五元与六元螯合)的双齿吡啶-吡啶酮配体的设计对于得到不同的产物至关重要。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ligand-controlled divergent dehydrogenative reactions of carboxylic acids via C–H activation
Zhen Wang, Liang Hu, Nikita Chekshin, Zhe Zhuang, Shaoqun Qian, Jennifer X. Qiao, Jin-Quan Yu
Science, 2021, DOI: 10.1126/science.abl3939
导师介绍
余金权
https://www.x-mol.com/university/faculty/694
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号