董广彬课题组Science:如何轻松实现1,2-羰基迁移?
羰基化合物不仅廉价易得,且在自然界中广泛存在,是一类非常重要的有机合成中间体。事实上,化合物中羰基的位置会显著影响其生物活性和理化性质,例如:将熊果酸中C3-OH迁移到相邻的C2位时会将糖原磷酸化酶的抑制效力提升13倍(图1A);去甲托品酮C2-羰基衍生化合物改善氨基糖苷类引起听力损伤的活性,要比相应的C3-羰基类似物高9倍。从合成的角度来讲,有效的1,2-羰基迁移策略还可以简化复杂分子(如:cascarillone 和lycoraminene)的合成步骤(图1B)。目前,最常用的1,2-羰基迁移策略是利用酮的α-官能团化引入羰基替代物或者形成三元环、1,2-二酮中间体,然后再进行后续的一系列转化(图1C)。这些策略不仅步骤冗长,而且底物的官能团耐受性和区域选择性很受局限,迫切需要发展一种通用且高效的1,2-羰基迁移策略。
近日,美国芝加哥大学的董广彬教授(点击查看介绍)课题组发展了一种简便的一锅或两锅法,将羰基中的氧转移到相邻碳上,实现了羰基的1,2-迁移(图1D)。具体而言,将酮化合物先转化为相应的烯基三氟甲磺酸酯,接着通过钯和降冰片烯(Pd/NBE)催化的区域选择性α-胺化和ipso-氢化得到“转位(transposed)烯胺”中间体,后者经水解便可得到所需的1,2-羰基迁移产物。相关成果发表在Science 上。
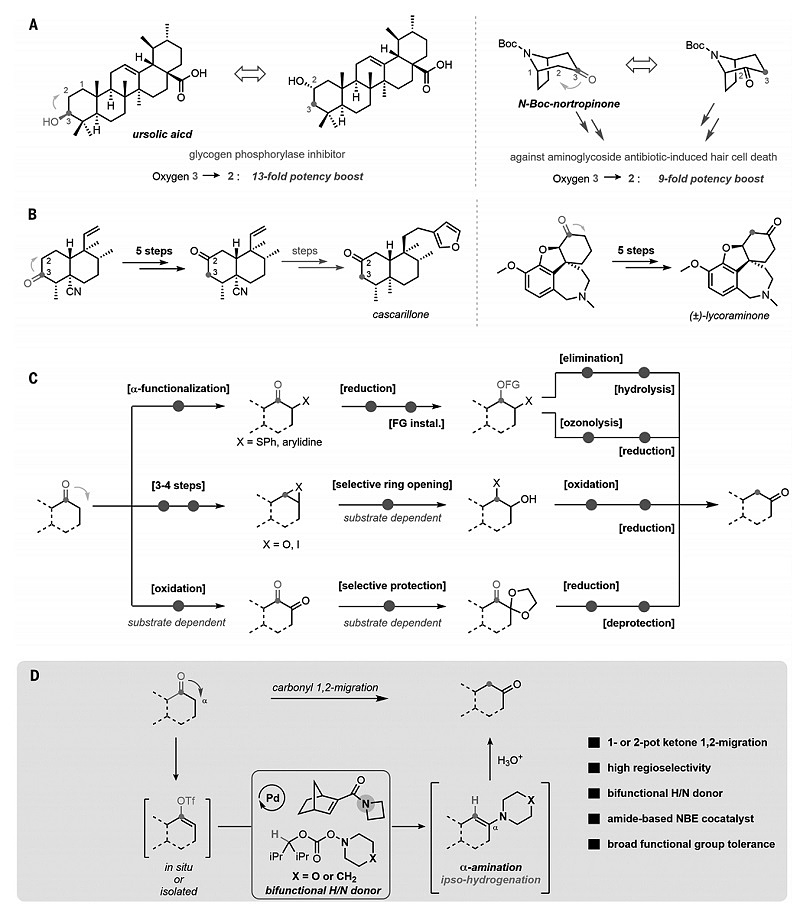
图1. 1,2-羰基迁移策略。图片来源:Science
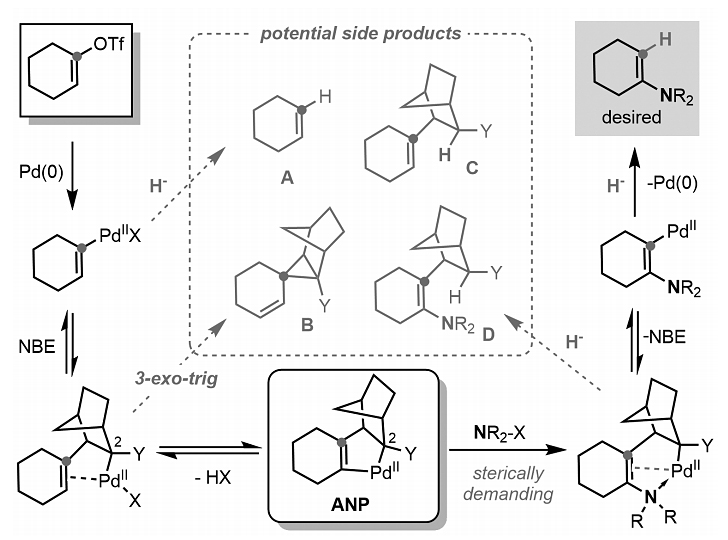
图2. Pd/NBE催化烯基三氟甲磺酸酯α-胺化面临的挑战。图片来源:Science
首先,作者选择α-四氢萘酮(1)为模板底物、Tf2O为三氟甲磺酸酯化试剂、Cs2CO3为碱、甲苯和1,4-二氧六环为混合溶剂于40 ℃下进行反应,以接近定量的收率得到烯基三氟甲磺酸酯2(图3)。随后,作者对Pd/NBE协同催化的烯基三氟甲磺酸酯的α-胺化和ipso-氢化条件进行了优化,最终以88%的收率一锅法得到了所需的β-四氢萘酮产物(3)。另外,对照实验表明钯催化剂和NBE对该反应至关重要,并且在没有吡啶酮添加剂的情况下产率大幅降低。
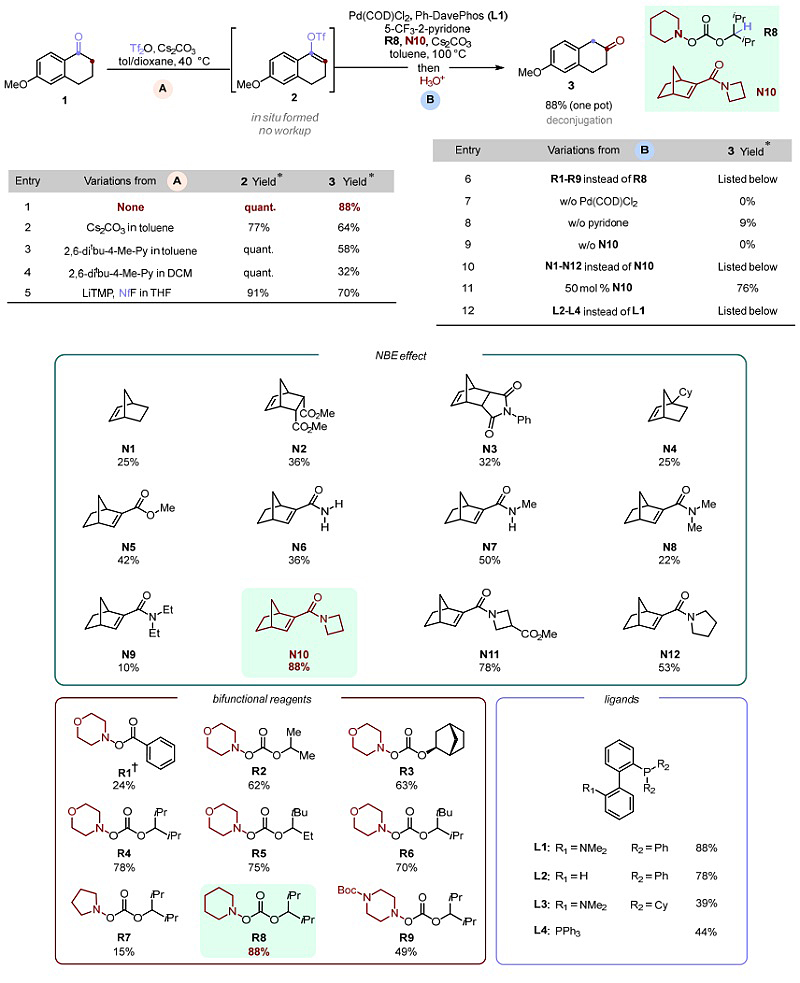
图3. 反应条件优化。图片来源:Science
在最优条件下,作者对该反应的底物范围进行了考察(图4),结果显示不同基团取代的α-四氢萘酮衍生物(5、6、8-14)、二氢苯并噻喃酮(7)、1-茚酮(15)、1-苯并环庚酮(16)甚至苯并环庚烯酮(17)均能实现一锅法转化,以中等至良好的收率得到所需的1,2-羰基迁移产物,其中底物7和13将烯基三氟甲磺酸酯中间体纯化后的总收率更高。此外,非共轭酮(18-33)也能兼容该反应,只不过两步法合成(使用LiTMP为碱)的收率更高,尽管一锅法也能提供所需产物(如18)。值得一提的是,该反应能够耐受多种官能团,例如:芳基氯(11)、氰基(10)、硝基(13)、苄醚(20)、磺酰胺(21)、烯基(22、30、34)、缩醛(31)、酯基(12、28)、内酯(34、38)、噻吩(8、14)、喹唑啉(23、24)、茶碱(25)和吲哚(26)等。有意义的是,天然产物(如托品酮(35)、诺蒎酮(36)、猪脱氧胆酸(37)和α-山道年(38))衍生的烯基三氟甲磺酸酯也能顺利地进行1,2-羰基迁移,以良好的收率提供相应的羰基迁移类似物。
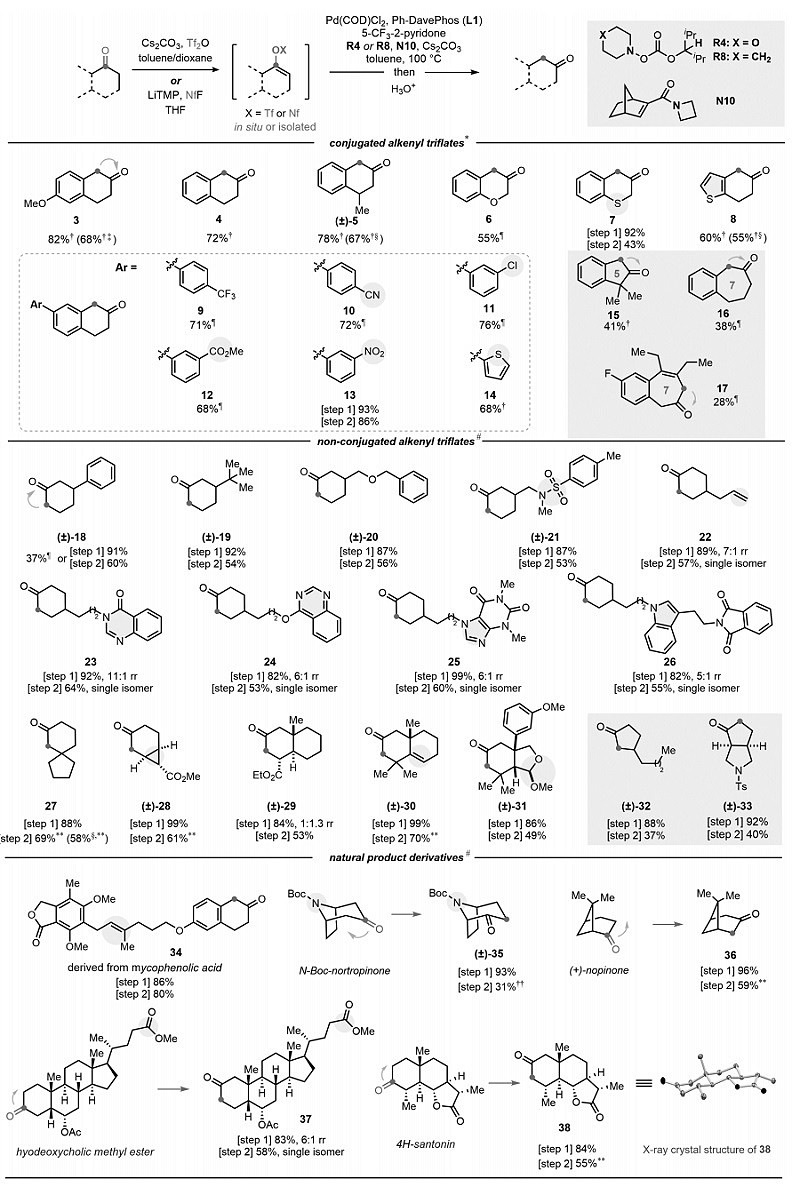
图4. 底物范围。图片来源:Science
如图5A所示,将β-取代的环己酮转化为γ-取代的环己酮很容易进行(如:22-26);但是向另一方向的羰基迁移(β→α)却较为困难,这是因为相应的烯醇化物(动力学不利)通常以低收率和低选择性形成。此外,在所需的烯基三氟甲磺酸酯中存在β-取代基会阻碍C-H键钯化,因此要想实现这种“β-to-α”转化可谓是难上加难。为此,作者尝试发展一种基于烯酮的替代策略(图5B)。具体而言,烷基亲核试剂与环己烯酮底物进行共轭加成,然后用Cominsˊ试剂淬灭,以中等至良好的收率得到所需的烯基三氟甲磺酸酯。考虑到β-空间位阻,作者认为体积较小的胺亲电试剂应该有利于C-H键胺化步骤。实际上,氮杂环丁烷衍生的亲电试剂(R10)效果最好,以中等的收率得到所需的β-to-α迁移产物(40和41)且相对立体化学完全保留,而先前的方法则是无法合成的。此外,从(+)-二甲基双环庚烯酮出发,经两步转化便可得到(-)-松樟酮(42)。鉴于酮的直接不对称非烯丙基α-烷基化极具挑战性,因此该策略对于手性纯α-烷基化酮的制备十分有用。例如,通过对映选择性共轭烷基加成和1,2-羰基迁移策略便可以优异的对映选择性获得α-乙基酮 43(图5C)。

图5. 通过共轭加成来实现β-取代。图片来源:Science
最后,作者探讨了该方法的合成应用(图6)。当Danishefsky’s二烯与Michael受体进行反应时,得到了C4位带有吸电子基团的环己酮(图6A);而利用本文的方法则可以良好的收率获得逆区域选择性Diels-Alder产物(即吸电子基团位于C3位)。除质子外,其它亲电试剂(如:烯丙基溴)也可以捕获烯胺中间体生成产物46(图6B)。有趣的是,不对称共轭加成和1,2-羰基迁移还能以对映选择性方式引入γ-立体中心。具体而言,从烯酮出发,经不对称共轭加成和1,2-羰基迁移得到手性纯的酮48,后者经非对映选择性还原得到醇中间体(49),随后进一步转化为食欲素受体拮抗剂(50),而先前的方法则是通过手性拆分制备的(图6C)。此外,从类固醇二氢睾酮醋酸酯和二氢胆甾酮出发,经两步转化便可得到生物活性的“C2-oxo”类似物;而先前则需要五步合成且总收率分别为<39%和10%(图6D)。最后,作者从简单易得的香叶基溴出发,仅需三步便可以32%的总收率合成trans-萘烷酮中间体54(pallescensin A全合成的关键中间体),而先前的方法则从Wieland-Miescher酮出发,需要八步才能合成,总产率仅21%(图6E)。

图6. 反应的合成应用。图片来源:Science
总结
董广彬教授课题组在钯/降冰片烯(Pd/NBE)的协同催化作用下,发展了一种简便实用的1,2-羰基迁移策略。该反应不仅底物范围广、官能团耐受性好,而且通过合理的试剂选择,可以控制羰基迁移的方向,从而生成γ-取代产物或更具挑战性的α-取代产物。毫无疑问,该策略非常适合药物优化过程中复杂分子的后期修饰与变化,有望成为天然产物及药物化学领域中的强大工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Carbonyl 1,2-transposition through triflate-mediated α-amination
Zhao Wu, Xiaolong Xu, Jianchun Wang, Guangbin Dong
Science, 2021, 374, 734–740, DOI: 10.1126/science.abl7854
导师介绍
董广彬
https://www.x-mol.com/university/faculty/352
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号