Science:机理独特的三氟甲基化,PET技术的新“氟”音
三氟甲基(CF3)是一种重要的含氟基团,将该官能团引入药物分子中常常会显著改变母体化合物的脂溶性,增强分子的代谢稳定性,并对其生物活性如药物的吸收、分布以及给-受体的相互作用造成影响。基于以上特殊性质,药物分子特定位置的三氟甲基化成为药物设计的一种常用手段。以肿瘤抑制剂埃博霉素D(Epothilone D)为例,将C12位的甲基使用三氟甲基取代后,C12、C13位的C=C双键发生氧化代谢的反应活性大大降低,且不影响Epothilone D抑制肿瘤的活性,从而延长其作用时间,减少药物降解带来的毒副作用。
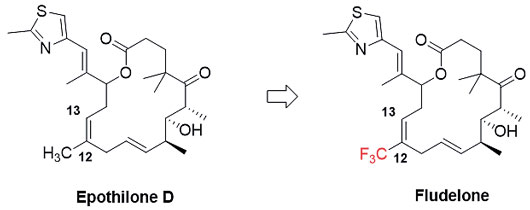
图1. Epothilone D与Fludelone的分子结构
另外,同位素18F的生物半衰期(t1/2)为109.77 min,可作为放射性探针用于正电子发射断层扫描(Positron Emission Tomography, PET)技术中进行肿瘤、心脑血管疾病的诊断。目前在PET技术中最为常用的药剂是18F标记的2-氟-2-脱氧-D-葡萄糖(F-FDG),这一示踪分子可以通过K18F对甘露糖的三氟甲磺酸衍生物亲核取代制得。与此同时,人们同样设想将18F标记的三氟甲基引入示踪分子中进一步扩展PET技术在临床医学影像中的应用。
最近,美国加州大学伯克利分校的F. Dean Toste教授与劳伦斯伯克利国家实验室的James P. O'Neil博士合作报道了一种高效快速构建C(sp3)-CF3键的方法,该反应以三氟甲基配位的Au(III)络合物为三氟甲基来源,B(C6F5)3为关键催化剂,通过独特的“氟负离子回弹”机理("fluoride-rebound" mechanism)可以得到多种不同结构脂肪烃的三氟甲基化产物。反应过程中涉及三氟甲基C-F键的断裂与重新形成,因而可以结合18F同位素标记的氟源合成具有放射性三氟甲基的示踪剂用于PET技术中。相关工作近期发表在Science 上。

图2. F-FDG的合成
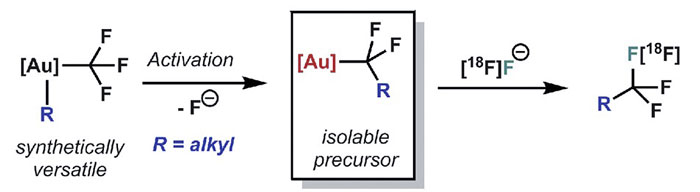
图3. 三氟甲基配位的Au(III)络合物为三氟甲基来源的C(sp3)-CF3键构建。图片来源:Science
根据反应经历的途径不同,三氟甲基化可以大体分为亲核三氟甲基化、亲电三氟甲基化以及自由基三氟甲基化。相应的氟烷基化过程可借助Ruppert-Prakash试剂、Togni试剂等三氟甲基合成子作为三氟甲基来源实现。以上过程均是将预先产生的三氟甲基活性物种作为整体引入目标分子,其间不涉及C-F键的断裂与形成,并不适用于构建18F同位素标记的三氟甲基基团,因而需要通过其他含氟官能团与放射性氟源发生适当的转化方能获得。以往的报道利用ClCF2COOMe、HCF2I等二氟卡宾前体在反应中原位产生二氟卡宾,随后与18F-结合,并进一步与体系中的亚铜盐作用得到“[18F]CuCF3”,该三氟甲基亚铜物种可与碘代芳香烃、芳基硼酸等sp2杂化的碳发生偶联,但无法作用于sp3杂化体系。而受立体电子效应的影响,三氟甲基负离子无法作为良好的亲核试剂直接对脂肪族卤代烃进行SN2亲核取代。寻找一种含有[18F]CF3的合适物种用于构建C(sp3)-[18F]CF3键便成为人们关注的问题。
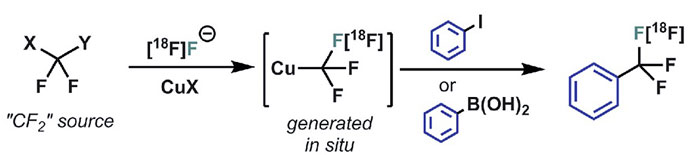
图4. 三氟甲基亚铜参与的C(sp2)-CF3键构建。图片来源:Science
F. Dean Toste教授及其团队在开展三氟甲基配位的Au(III)络合物相关的研究时偶然发现,在-15 ℃的低温条件下,化学计量的B(C6F5)3可促进氮杂环卡宾配位的Au(III)络合物1a发生形式上的C(Me)-CF3键还原消除。当他们以催化量(20%)的B(C6F5)3与1a混合,核磁共振19F谱监测C(Me)-CF3键还原消除的情况,反应在室温条件下5分钟内便可完成转化得到IPrAuCF3,使用PCy3配位的Au(III)络合物1b可以观察到相同的结果。结合验证实验与前期的研究工作,他们认为三氟甲基配位的Au(III)络合物在B(C6F5)3的存在下发生了如下过程:以1a为例,B(C6F5)3从1a的其中一个CF3攫取一分子F-形成Au(III)二氟卡宾活性物种,随后发生烷基迁移插入,进而发生C-F键还原消除得到三氟乙烷。B(C6F5)3促使三氟甲基的C-F键发生断裂,与此同时结合F-形成超共价中间体,随后通过F-回弹重新构成催化循环。
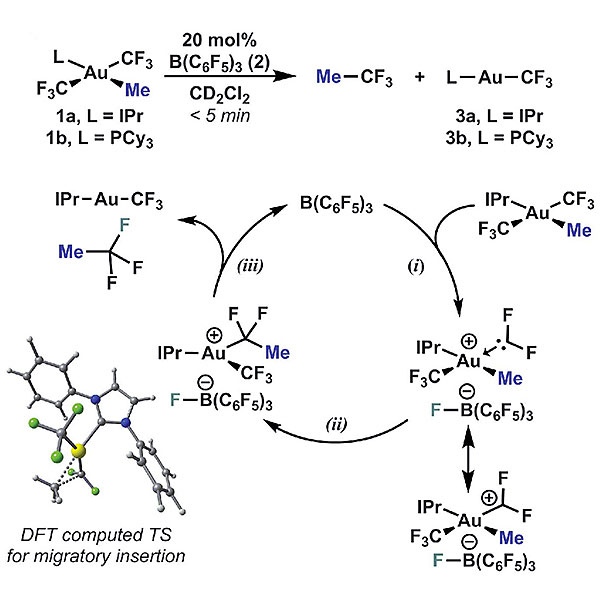
图5. B(C6F5)3催化的“氟负离子回弹”过程。图片来源:Science
受以上反应过程的启发,作者设想如果可以有效阻断F-的回弹并引入18F同位素标记的氟源,便可能实现[18F]CF3基团的构建。他们将与F-具有不可逆结合作用的Me3SiBr加入反应体系得到可分离的Au(III)络合物,这种中间体以Br-与CH3CF2-对Au(III)金属中心配位,在分离后仍然保持相应的反应活性,使用AgF处理便得到三氟乙烷产物。
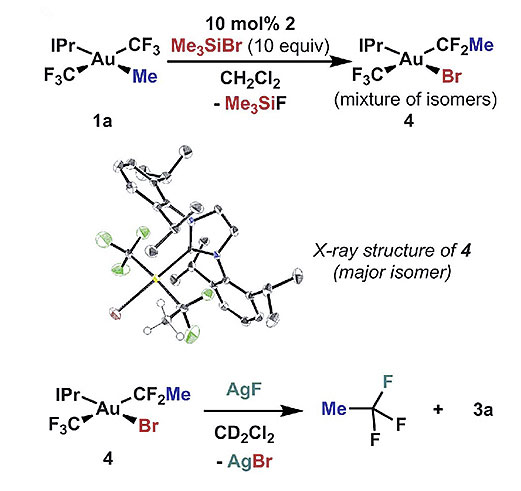
图6. Au(III)金属中心形式上C(sp3)-CF3键还原消除反应的研究。图片来源:Science
作者随后尝试改变Au(III)络合物的甲基为其他烷基配体对该反应进行考察,烯丙基与复杂脂肪烃配位的Au(III)物种形式上的还原消除过程均可以顺利发生。除此之外,芳基配位的Au(III)物种同样可以参与反应。Au(III)络合物对水及空气不敏感,甚至可以使用硅胶柱层析进行分离纯化。反应中不同的Au(III)中间体仅在强酸条件下发生分解,对环丙烷化、过渡金属催化剂参与的偶联反应以及不同的氧化条件均能很好地兼容,即便在芳基配体发生硝化的剧烈反应条件下也不会发生Au-C键断裂。
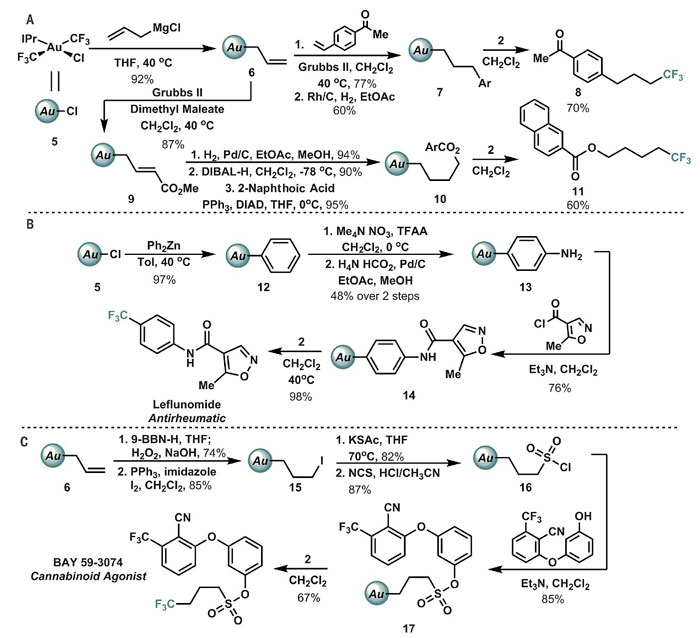
图7. 三氟甲基配位的Au(III)络合物的多样性合成。图片来源:Science
有了以上结果的支持,F. Dean Toste教授与James P. O'Neil博士继续联合开展18F同位素标记的三氟甲基在PET技术中的应用研究。理论上他们可以使用Ag18F作为放射性氟源借助图6设计的过程做进一步考察,但由于Br-与Au(III)金属中心的结合能力较强,AgF中的F-与Au(III)中Br-的配体交换过程较为缓慢,在用于快速制备[18F]CF3修饰的示踪分子时仍不够理想。于是他们需要使用其他配位能力更弱的阴离子交换Br-,得到的Au(III)络合物再与放射性氟源混合,从而缩短Au(III)物种发生C-F键还原消除的时间。研究发现使用AgOAc与Au(III)络合物中的Br- 发生交换可以得到具有合适稳定性与反应活性的Au(III)中间体,结合放射性氟源K18F与Kryptofix [2.2.2]的混合物则可以快速得到[18F]CF3修饰的脂肪烃产物。
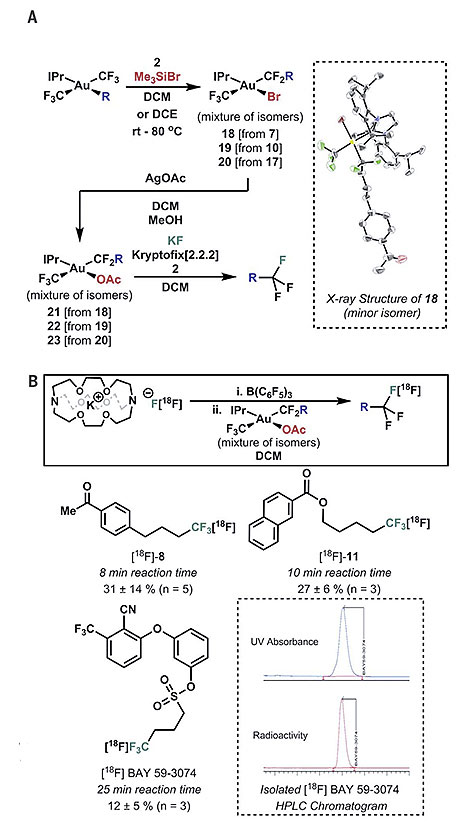
图8. [18F]CF3修饰的示踪分子合成。图片来源:Science
——总结——
F. Dean Toste教授与James P. O'Neil博士合作报道了以三氟甲基配位的Au(III)活性物种为三氟甲基来源构建C(sp3)-CF3键的方法,该反应可以成为三氟甲基亚铜参与C(sp2)-CF3键形成的很好补充。这两种方法均涉及外界亲核氟源引入形成新的C-F键,因而可以结合放射性亲核氟化试剂合成[18F]CF3修饰的示踪剂,扩展18F同位素在PET技术中的应用。三氟甲基配位的Au(III)络合物具有合适的稳定性与反应活性,对多种条件剧烈的反应可以很好地兼容,这种性质在以往考察其他过渡金属络合物时十分少见。尽管18F同位素标记的示踪剂在PET技术的诊疗中使用剂量很低,但考虑到反应过程中需要使用化学计量的贵金属盐,该反应仍具有很大的成本降低空间。开展廉价过渡金属的催化途径合成[18F]CF3修饰的示踪分子将成为研究工作者努力的方向。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A catalytic fluoride-rebound mechanism for C(sp3)-CF3 bond formation
Science, 2017, 356, 1272, DOI: 10.1126/science.aan1411
(本文由夜若岚尘供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号