中国药科大学陆涛团队JMC:克服FLT3抑制剂耐药性方面的重要进展
急性髓性白血病(AML)在成人白血病中最常见,在儿童白血病中也高居第二位。由于其患者预后差,死亡率高,因此给临床治疗带来了巨大的挑战。近年来,靶向药物治疗发展迅速,逐渐成为肿瘤治疗的重要手段。其中,Fms-like tyrosine kinase 3(FLT3)是AML治疗中的重要靶点。研究表明,70%以上的AML患者体内FLT3高表达,30%左右的AML患者体内FLT3发生突变。迄今为止,3个FLT3抑制剂已在美国或者日本上市,并有多个抑制剂处于临床评估状态。尽管这些FLT3抑制剂单独使用或与其他疗法配合使用都能够缓解疾病症状,提高生存率,但患者在接受治疗后会较快产生耐药性,导致FLT3抑制剂持续响应期较短,疾病复发,削弱临床疗效。因此,克服FLT3抑制剂耐药性,提高AML治疗效果,延长患者生存期已成为临床上亟待解决的难题。其中,获得性点突变是导致FLT3抑制剂产生耐药性的主要机制之一,已成为目前研究的热点。
近日,中国药科大学陆涛/陈亚东教授研究团队的卢帅副教授基于他们先前报道的FLT3抑制剂Lu-46,通过合理的药物设计手段对其进行结构修饰,发现了能够有效克服FLT3多种获得性点突变(包括FLT3-ITD-D835V, FLT3-ITD-F691L, FLT3-ITD-Y842H)的抑制剂67(LT-850-166)(图1)。陆涛/陈亚东教授团队长期致力于高效抗AML药物的研究,在FLT3、CDK9、BRD4等靶点的抑制剂开发方面取得了众多成果,其中FN1501已经在中国、美国、澳大利亚等国开展I期临床试验。

图1. 研究思路
在FLT3获得性点突变中,F691突变是最具挑战同时发生率较高的点突变。因此,研究团队首先针对F691突变,分析了化合物Lu-46与FLT3-WT(图2A和2C)和FLT3-F691L(图2B和2D)的结合模式,发现当发生F691L突变时,苯并二噁茂与Phe691残基的π−π相互作用丢失,同时立体位阻引入。此外,在保留吡唑胺等基本骨架的前提下,可以修饰苯并二噁茂区域以引入额外的基团占据FLT3的核糖区,从而增强与FLT3的结合力。由于直接对苯并二噁茂修饰比较困难,研究团队首先发现了与Lu-46具有同等酶抑制活性的化合物31;随后在化合物31的基础上,引入不同的基团以占据核糖区,得到化合物41(图3);分析41与FLT3的结合模式(图4)可知,41的苄基区域占据了核糖区,且被Leu616、Gly617、Ser618、Gly619、Lys644、Glu661、Cys828 和 Asp829残基的疏水性侧链或主干紧密包围,因此进一步调查了在苄基的苯环上引入不同的取代基对活性的影响,从而得到活性进一步提高的化合物55;最后,通过对亲水区片段的筛选以及苄基苯环上取代的进一步探讨,从而获得了候选化合物67(图3)。
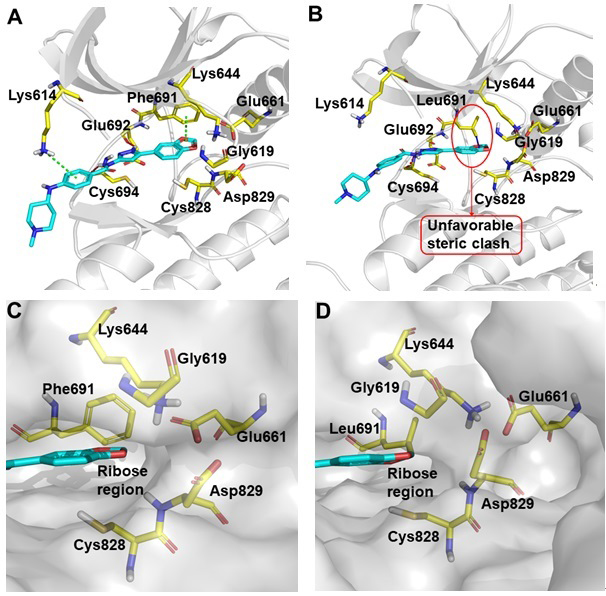
图2. 化合物Lu-46与FLT3-WT(A, C)和FLT3-F691L(B, D)的结合模分析。
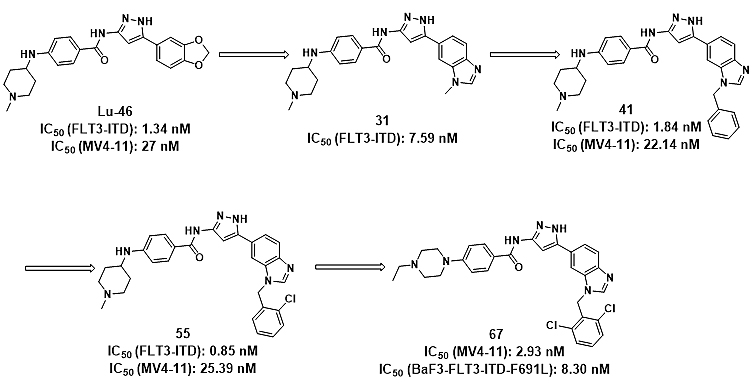
图3. 化合物67的发现简要过程。

图4. 化合物41与FLT3-WT的结合模式分析。
随后,研究团队测试了化合物67对多种FLT3获得性点突变的抑制活性。结果表明(表1),67对多种获得性点突变包括FLT3-ITD-D835V、FLT3-ITD-F691L、FLT3-ITD-Y842H表现出优异的抑制活性,且与FLT3-ITD的抑制活性相当。但67对FLT3-ITD-N676D稍弱。分子动力学模拟解释了67具有高抑制活性的原因。67除了与Cys694和Glu692形成氢键外,还通过水分子作桥与其他氨基酸残基形成氢键(图5);此外,苯环上的两个氯原子分别占据了由Leu616、Gly617、Ser618、Val624形成的口袋1和由Arg815、Asn816、Cys828、Asp829形成的口袋2(图6),并与Leu616、Asn816和Cys828残基形成卤键,所有模型中除了N676D(12%)总占据率超过33%(图5);与单氯取代的55相比,两个氯原子限制了2,6-二氯苯基的构象,从而有更低的灵活度与RMSF;对于N676D模型,更高的灵活度和更低的卤键可能解释了67对FLT3-ITD-N676D活性稍弱的原因。
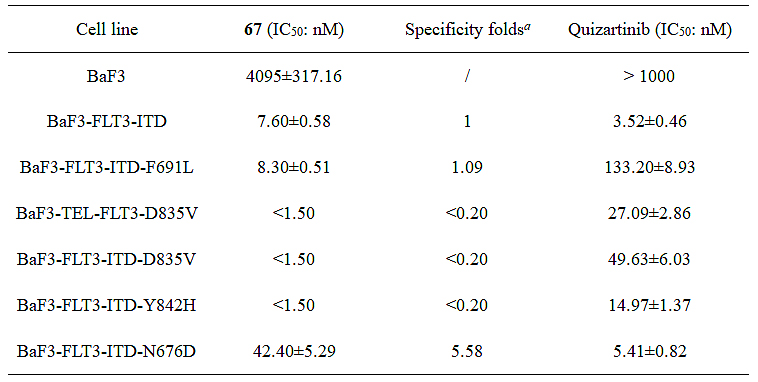
表1. 化合物67对多种FLT3突变体转染的BaF3细胞的抗增殖活性。
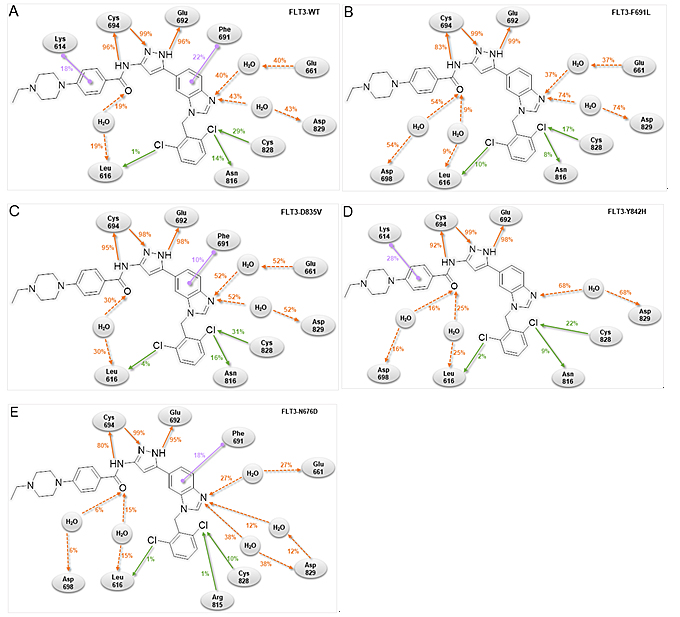
图5. 化合物67与FLT3-WT (A), FLT3-F691L (B), FLT3-D835V (C), FLT3-Y842H (D) and FLT3-N676D (E)的动态结合模式。
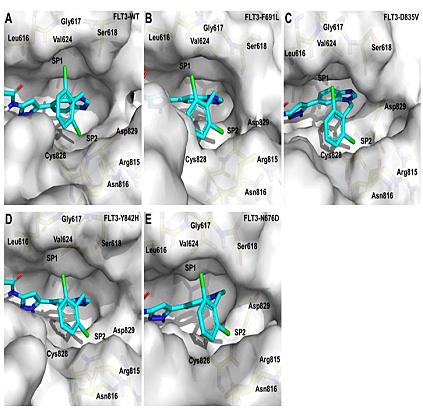
图6. 两个氯原子(67)分别占据SP1和SP2两个口袋。
在机制研究中,化合物67在MV4-11(图7A)、BaF3-FLT3-ITD-D835V(图7B)和BaF3-FLT3-ITD-F691L(图7C)细胞中,都能够有效抑制FLT3及其下游蛋白的磷酸化,并且呈剂量依赖形式,证明了其在靶活性;此外,化合物67能够有效诱导MV4-11细胞凋亡(图8),并阻滞MV4-11细胞周期停留在G1期(图9)。
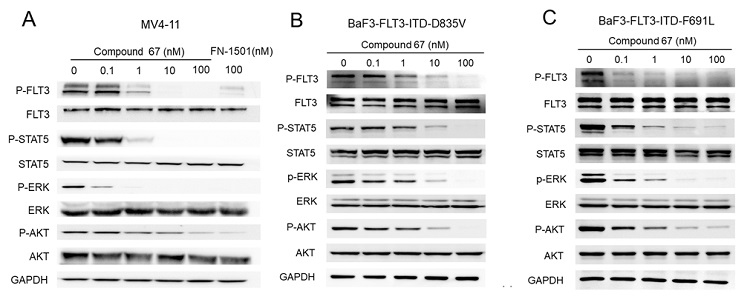
图7. 化合物67在MV4-11 (A), BaF3-FLT3-ITD-D835V (B) 和BaF3-FLT3-ITD-F691L (C)细胞中对FLT3介导的信号通路的影响。
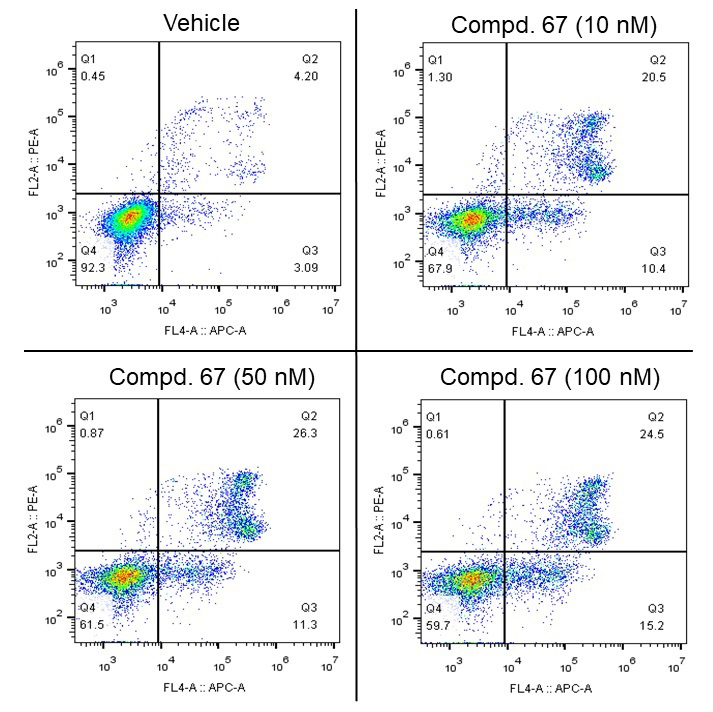
图8. 化合物67诱导MV4-11细胞发生凋亡。
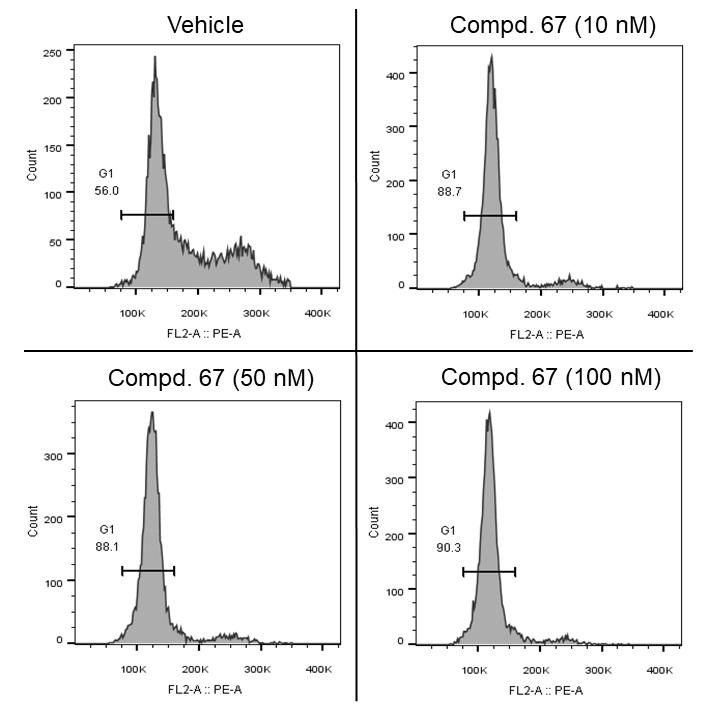
图9. 化合物67阻滞MV4-11细胞周期停留在G1期。
最后,研究团队进一步对化合物67进行了体内抗AML药效评价(图10)。在MV4-11异种移植瘤小鼠模型中,15 mg/kg静脉注射给药21天,化合物67表现出优异的抗肿瘤活性,对肿瘤的生长抑制率(TGI)达到99.45%,且小鼠体重无明显下降,对主要器官、血液指标无明显毒性,表明化合物67的安全性较好。
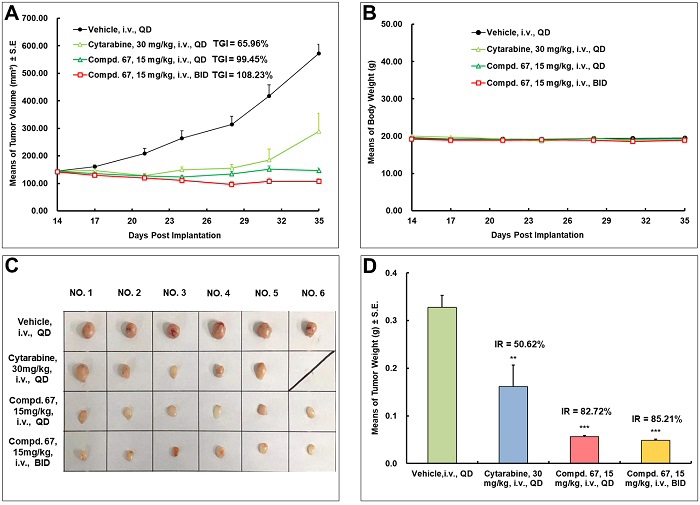
图10. 化合物67体内抗AML药效评价。
总之,研究人员通过计算机辅助药物设计,系统地进行了构效关系研究,证明了FLT3的核糖区可以被用于增强化合物与FLT3的结合力,从而进一步克服耐药性,这一药物设计策略可能对激酶类药物的开发具有重要指导意义。候选化合物67表现出了优异的体内外抗肿瘤活性及克服获得性点突变耐药性的潜力。
该成果近期发表在国际药物化学顶级期刊Journal of Medicinal Chemistry 上,中国药科大学卢帅副教授负责整合课题的设计与规划,陆涛教授和陈亚东教授给予技术指导,李红玫副研究员提供药理活性研究支持,中山大学附属第七医院陈韵教授和上海交通大学吴英理教授对该课题有重要贡献,中国药科大学赵茜女士亦对该课题提供了众多帮助!王志杰博士为论文的第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery of a Potent FLT3 Inhibitor (LT-850-166) with the Capacity of Overcoming a Variety of FLT3 Mutations
Zhijie Wang, Jiongheng Cai, Jiwei Ren, Yun Chen, Yingli Wu, Jie Cheng, Kun Jia, Fei Huang, Zitian Cheng, Tiancheng Sheng, Shiyu Song, Hao Heng, Yifan Zhu, Weifang Tang, Hongmei Li*, Tao Lu*, Yadong Chen*, Shuai Lu*
J. Med. Chem., 2021, DOI: 10.1021/acs.jmedchem.1c01196
论文作者介绍
陆涛:中国药科大学教授,江苏省教学名师,副校长。《药学进展》执行主编,《中国药科大学学报》编委。主要研究方向:新药分子设计与合成研究、计算机辅助药物设计、有机合成化学、药物生物统计与计算药学。团队自主研发的抗肿瘤化合物以1.5亿合同价格转让给上海复星医药产业有限公司,目前正在美国、澳大利亚和中国同时开展I期临床研究,主要用于治疗急性髓细胞白血病(AML),2019年11月该药物获美国FDA孤儿药资格认定。
https://www.x-mol.com/university/faculty/50222
陈亚东:中国药科大学教授,曾获江苏省“青蓝工程”优秀青年骨干教师,江苏省 “青蓝工程”中青年学术带头人。主要研究方向:计算机辅助药物设计、新药分子设计与合成研究、药物生物统计与计算药学。申请国内专利14项,PCT专利3项;在J. Med. Chem., Eur. J. Med. Chem.,J. Chem. Inf. Model.等期刊发表SCI论文80多篇。
https://www.x-mol.com/university/faculty/65913
卢帅:中国药科大学副教授。研究方向为小分子靶向抗肿瘤药物的设计与合成,以及利用CADD和AI技术发现针对肿瘤、炎症等疾病的新分子实体。主持并参与多项国家自然科学基金、江苏省自然科学基金及中央高校基本科研业务费项目。在JMC、EJMC、JCIM等药物化学领域杂志上发表学术论文15篇以上,获得中国授权发明专利6项。参与I类抗急性髓性白血病临床候选药物FN-1501的研发。
李红玫:药物化学博士,副研究员,硕士生导师。主要研究方向为药物化学,通过药物化学、化学生物学、药理学等多学科交叉,进行小分子创新药物研究。作为项目负责人,主持国家自然科学基金、江苏省自然科学基金、以及中国博士后基金。近五年在Sci adv, Eur J Med Chem, Mol Pharm等学术期刊发表论文多篇,申请国家专利多项,2019年获江苏省医药科技奖二等奖(排名第五)。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号