招募KEAP1实现目标蛋白质高选择性靶向降解
蛋白质水解靶向嵌合体(PROTAC)技术如今正受到药物研发领域的极大关注。其原理是利用小分子劫持细胞内的E3泛素连接酶和泛素-蛋白酶体系统(UPS),介导靶标蛋白的降解。相对于小分子抑制剂,PROTAC技术有很多特有的优势,如可以降解所谓“不可成药”的蛋白靶点(例如某些转录因子、骨架蛋白等),具有催化活性等。迄今为止,在已发现的将近600种人类E3连接酶中,只有很少的几种被用于PROTAC的开发,其中应用最为广泛的是CRBN和VHL。由于PROTAC技术高度依赖于E3连接酶,当所劫持的E3连接酶表达水平很低时,靶标蛋白不能被有效降解。因此,丰富可使用的E3连接酶,尤其是发展肿瘤细胞中表达水平较高的E3连接酶,将会极大促进该领域的发展。
西奈山伊坎医学院的金坚教授(点击查看介绍)课题组长期致力于开发新型PROTAC技术,以及推进这些技术的临床应用。最近,他们通过招募KEAP1蛋白实现了BRD系列蛋白的选择性降解,丰富了PROTAC技术可选择的E3连接酶,拓展了靶向蛋白降解的工具箱。
KEAP1是cullin 3 E3连接酶复合物的重要组成部分,在生物体内起着调控Nrf2蛋白水平的作用。通常情况下,KEAP1和cullin 3骨架蛋白、RBX1蛋白结合成复合物,随后结合Nrf2蛋白并介导其泛素化,最后使其降解。值得注意的是,KEAP1的表达水平在人类肿瘤细胞中非常高,特别是人肺腺癌、肾透明细胞癌、浸润性乳腺癌、前列腺腺癌、胶质母细胞瘤等恶性肿瘤细胞。因此,招募KEAP1蛋白实现关键靶点的降解成为治疗这些恶性肿瘤的一种潜在策略。
此前虽有几例关于利用KEAP1的PROTAC报道,但这些PROTAC分子细胞吸收性和药物动力学性质不佳,并且对于靶标蛋白的选择性不好,因此很难作为通用方法构建PROTAC分子。在本项研究中,作者利用前人报道的KEAP1高选择性非共价配体KEAP1-L发展了一种招募KEAP1构建PROTAC的通用方法,他们构建的PROTAC分子MS83可以选择性降解BRD4和BRD3,对其他含有溴结构域的蛋白如BRD1、2、7、8、9不起作用。
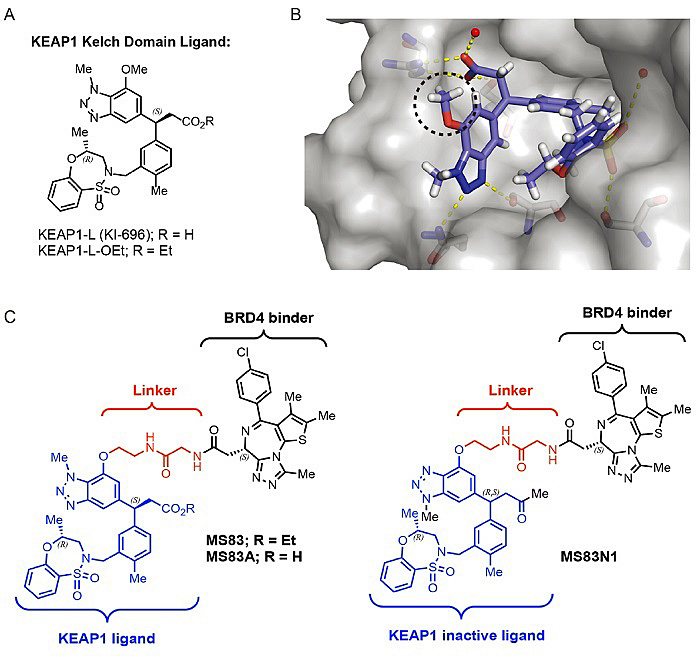
图1. 本项研究构建的PROTAC分子MS83和阴性对照组MS83N1的分子结构
KEAP1-L和KEAP1的共结晶结构清晰显示,其占据了Nrf2的结合位点,分子中的羧基包埋在KEAP1蛋白中,与氨基酸残基有关键性相互作用。同时,分子中的甲氧基溶剂可及,且很适合接上构建PROTAC所需要的连接链。在另一方面,作为一项概念性研究,作者选择已被广泛用于构建各种PROTAC的BET抑制剂(+)-JQ1,期望利用KEAP1构建BRD4的降解剂。基于以上设想,作者将KEAP1-L和(+)-JQ1用连接链连接起来,构建了PROTAC分子MS83及其前药MS83A。将KEAP1-L分子中的酯基改为酮羰基,构建了阴性对照分子MS83N1(图1)。
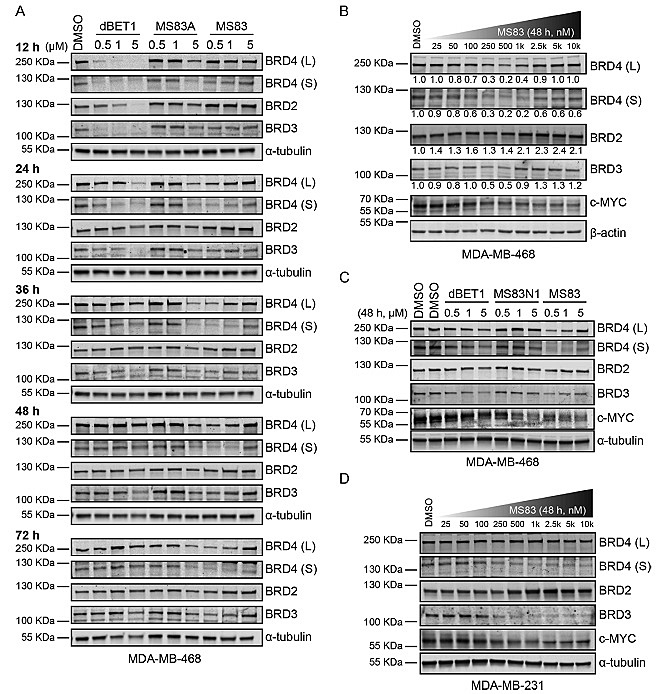
图2. MS83和MS83A对BRD4和BRD3的选择性降解
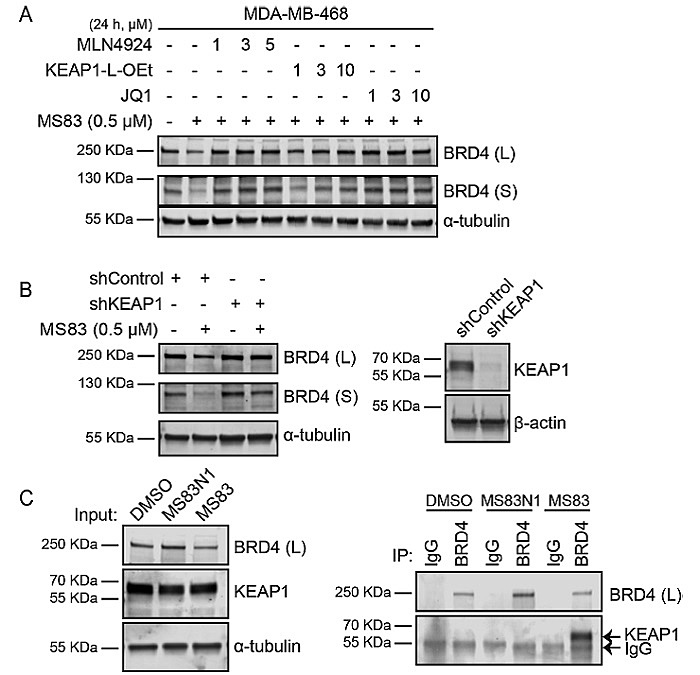
图3. KEAP1 介导MS83对BRD4的降解
使用三阴性乳腺癌细胞系MDA-MB-468来检测MS83、MS83A及基于CRBN的BRD4降解剂dBET1对BRD系列蛋白的降解效果(图2)。12小时后,MS83A和dBET1显著地降解了BRD4蛋白,然而在36小时之后,dBET1处理的细胞BRD4蛋白水平明显恢复,尤其是BRD4(L)恢复至处理前水平;MS83A对BRD4的降解作用可以持续更长时间,72小时之后蛋白水平都没有明显上升。MS83则显示了对BRD4更缓慢的降解,但是相对于MS83A的高浓度,MS83在低浓度时即显示出对BRD4有效的降解作用,且降解效果也能持续72小时。与之对应,MS83N1不能降解BRD4蛋白。进一步的生化实验表明,MS83对其降解是通过招募KEAP1蛋白实现的(图3)。
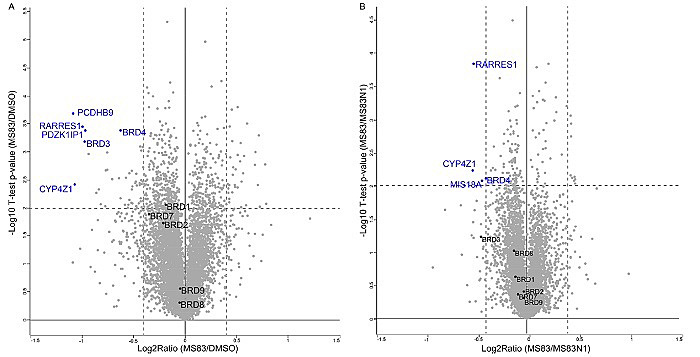
图4. 定量蛋白质组学研究表明MS83选择性地降解BRD4和BRD3蛋白
作者通过基于质谱的定量蛋白质组学实验证明,MS83在一系列BRD蛋白家族中可以选择性地降解BRD4和BRD3,其他BRD蛋白没有受到影响(图4)。
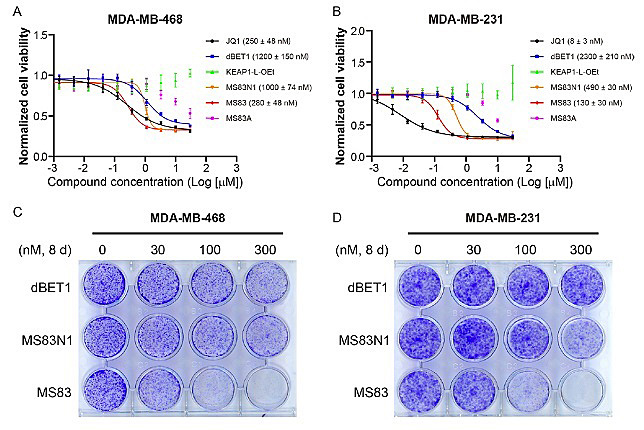
图5. MS83对三阴性乳腺癌细胞增殖抑制效果
为了进一步验证MS83对癌细胞的抑制效果,作者考察了其对两种三阴性乳腺癌细胞的增殖抑制作用。在本项目研究的降解剂和抑制剂中,小分子抑制剂JQ1因其更好的透膜效果而显示出对两种癌细胞最好的抑制效果。但是值得指出的是,MS83显示出远好于dBET1及MS83N1的抑制效果。同时,KEAP1-L-OEt没有显示出对肿瘤细胞的增殖抑制,表明MS83的抑癌作用并不是因为对KEAP1蛋白的抑制而引起的。
综上所述,作者实现了通过特异地招募KEAP1蛋白对BRD系列蛋白的选择性降解。该研究为将来使用KEAP1这一广泛高表达于癌细胞中的E3连接酶来实现对不同靶蛋白的降解打造了很好的基础。这一成果近期发表在J. Am. Chem. Soc.上,共同第一作者为魏杰丽博士和孟繁烨博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Harnessing the E3 Ligase KEAP1 for Targeted Protein Degradation
Jieli Wei, Fanye Meng, Kwang-Su Park, Hyerin Yim, Julia Velez, Prashasti Kumar, Li Wang, Ling Xie, He Chen, Yudao Shen, Emily Teichman, Dongxu Li, Gang Greg Wang, Xian Chen, H. Ümit Kaniskan*, and Jian Jin*
J. Am. Chem. Soc., 2021, 143, 15073–15083, DOI: 10.1021/jacs.1c04841
金坚教授简介

金坚,著名药物化学家, 美国西奈山医学院冠名教授,西奈山医疗发展中心主任, 西奈山伊坎医学院药理学系、肿瘤和神经科学系、帝势癌症研究所终身教授。本科毕业于中国科学技术大学;博士毕业于宾夕法尼亚州立大学,师从著名有机化学家Steven M. Weinreb。
金坚教授具有二十多年的小分子药物研发经验,在国际药物化学界享有盛誉。曾任葛兰素史克(GlaxoSmithKline)公司药物化学部门总监、北卡罗来纳大学教堂山分校药物化学部副主任等职。金坚教授课题组的研究方向主要为:(1)组蛋白甲基转移酶选择性抑制剂的发现;(2)G蛋白偶联受体偏向性配体的开发;(3)靶向肿瘤蛋白新型降解剂的研制。迄今为止已在相关领域发表近200篇SCI论文,包括Nature, Science, Cell, Nat. Med., Nat. Rev. Drug Discov., Nat. Biotechnology, Nat. Chem. Biol., Nat. Reviews Cancer, Cancer Cell, Nat. Cancer, J. Am. Chem. Soc., Angew. Chem. Int. Ed., Sci. Adv., Nat. Commun., J. Med. Chem.等;申请美国及国际专利60余项。
金坚
https://www.x-mol.com/university/faculty/311500
课题组主页:
https://labs.icahn.mssm.edu/jinlab/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号