不对称傅克反应构建N-N轴手性化合物
轴手性联芳基化合物广泛存在于许多重要的天然产物和药物活性分子中,并且是许多配体和催化剂的核心骨架。目前,C-C联芳基轴手性化合物的合成研究受到广泛关注取得了长足发展。近年来,基于N-C轴手性化合物的不对称合成同样吸引了化学家们的广泛研究兴趣。然而,与C-C和N-C键轴手性相比,围绕N-N键限制性旋转引起的轴手性在很大程度上被忽视了。其对映选择性合成始终尚未解决。近日,青岛大学的刘人荣教授团队通过吡咯去对称化策略首次实现了N-N键轴手性联芳基化合物的构筑。
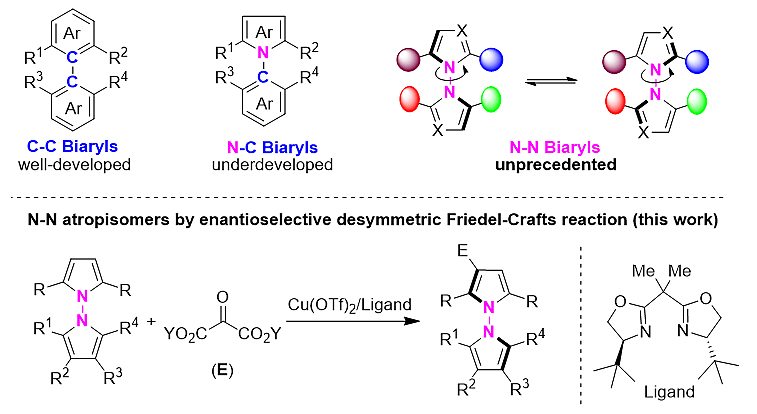
图1. 联芳基轴手性化合物的不对称合成
实际上,N-N键轴手性骨架同样存在于众多天然产物 (如:Dixiamycins A and B,β-Carboline dimer和Schischkininiin)、药物活性分子 (N-Carboline salt) 以及功能材料 (DOBCz) 中。早在 1931年,美国伊利诺伊大学香槟分校的Adams教授通过马钱子碱对联吡咯二羧酸进行拆分首次证实了N-N键轴手性的存在。然而在随后近90年的时间里,N-N联芳基轴手性化合物的研究始终没有引起化学家们的重视。直到最近,Pierini 和Cirilli (J. Chromatogr. A., 2014, 1363, 128) 以及Higashibayashi (EJOC, 2021, 449) 分别通过手性高效液相色谱实现了C2对称性N-N联芳基苯并咪唑和咔唑结构的拆分获得了光学活性化合物。然而,目前仍然缺乏有效催化手段实现N-N联芳基轴手性化合物的对映选择性合成。
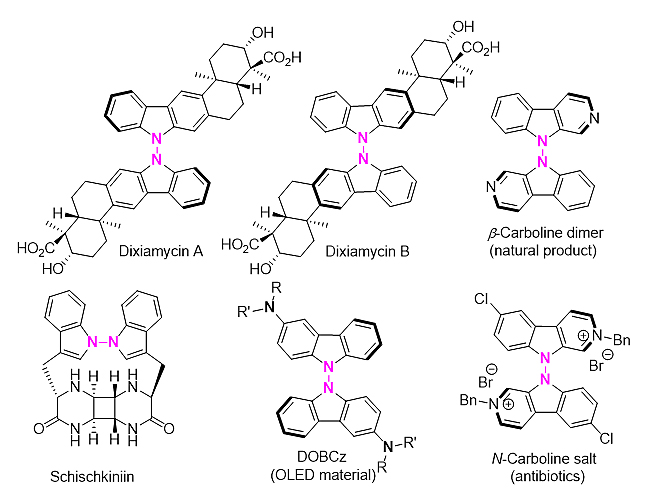
图2. 具有代表性的N-N联芳基轴手性化合物
青岛大学刘人荣研究团队目前致力于杂原子轴手性化合物的构筑。最近他们实现了脒类化合物的不对称Buchwald-Hartwig偶联构筑轴手性N-C联芳基骨架结构(Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202108747)。
考虑到N-N轴手性化合物在天然产物及药物设计中的潜在应用,他们通过采用路易斯酸催化的联吡咯去对化傅克烷基化策略成功实现N-N联芳基轴手性化合物高效不对称合成,为N-N 轴手性化合物的合成提够了一条简洁高效的方法。该方法采用简单易得的Cu(OTf)2/BOX作为催化体系,在最优条件下,对底物的适用范围进行了考察。结果表明,反应具有非常广的底物普适性,卤化物、硝基、酰胺以及杂环都能得到比较好的结果,以非常高的收率和对映选择性得到N-N联吡咯轴手性化合物。除此之外,反应同样适用于N-N非联芳基化合物的构建,当N-N键两端连接不同种类杂环结构,如吡咯-噻唑烷酮、吡咯-嘧啶酮和吡咯-三嗪酮骨架结构时,同样能够以较高的收率和良好的对映选择性得到N-N双杂环轴手性化合物。
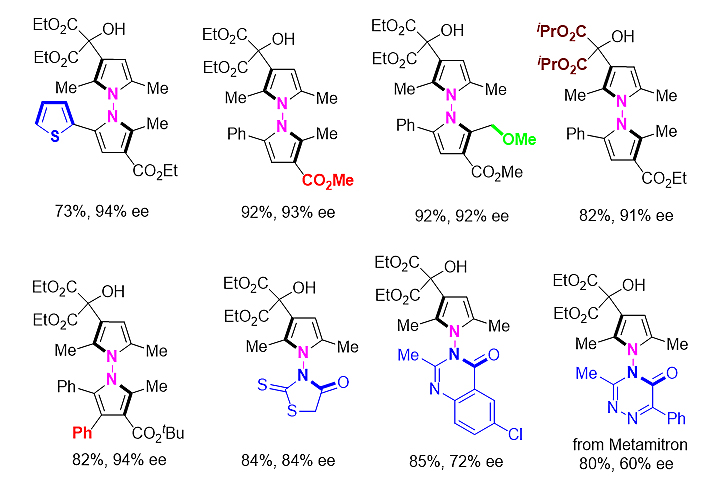
图3. 文章中代表性N-N双杂环轴手性化合物
为了证明这些N-N轴手性化合物的立体化学稳定性,作者进行了外消旋化实验。将结构不同的双杂环化合物分别加热到120 ℃或130 ℃,并用手性高效液相色谱法监测外消旋反应。所有化合物均表现出良好的构型稳定性,24小时均未发生外消旋。然而当温度高于140 ℃时,这些化合物出现不同程度分解,这些结果表明这类化合物外消旋能高于它们的降解能。
这一成果近期发表在J. Am. Chem. Soc.上,文章的第一作者是青岛大学硕士研究生王晓梅。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Synthesis of Nitrogen–Nitrogen Biaryl Atropisomers via Copper-Catalyzed Friedel–Crafts Alkylation Reaction
Xiao-Mei Wang, Peng Zhang, Qi Xu, Chang-Qiu Guo, De-Bing Zhang, Chuan-Jun Lu*, and Ren-Rong Liu*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c07741
导师简介
刘人荣,青岛大学化学化工学院教授。2013年于华东师范大学取得博士学位,2013至2019年分别在浙江工业大学、浙江大学/九洲药业、科罗拉多州立大学从事教学、科研以及博士后研究工作,2019年10月起就职于青岛大学。研究领域是过渡金属催化不对称有机合成。以第一或通讯作者在JACS、Angew等杂志发表SCI论文40余篇。2019年入选山东省泰山学者青年专家支持计划。
卢传君,青岛大学讲师,2013年博士毕业于中山大学药学院,以第一或通讯作者发表SCI论文10余篇,主要从事药物合成及有机合成方法学研究。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号