JACS:系统性调节罗丹明染料“开-闭”环比例实现STED和SMLM超分辨成像研究
荧光成像显微镜为生命科学和医药学研究提供了最为重要的成像工具。然而由于光衍射作用,传统荧光显微镜分辨率最高为200纳米左右。而超分辨显微成像技术,如受激辐射损耗(STED)显微术和单分子定位超分辨成像(SMLM),可突破光衍射极限,将显微镜分辨率提高到几十甚至几个纳米,为细胞结构观测及功能研究提供了前所未有的际遇。
基于罗丹明类染料构建的荧光探针是目前活细胞超分辨成像中最为常用的探针。罗丹明类染料的独特之处在于可形成两种不同结构的动态平衡:1.具有强荧光的两性离子结构(开环)2.无荧光但具有高透膜能力的螺内酯结构(闭环)。在之前的研究(Nat Chem, 2020, 12, 165)中,马克斯普朗克医学研究所Kai Johnsson教授和复旦大学王璐青年研究员提出一种罗丹明类染料优化的普适性方法:通过引入缺电子磺酰胺结构,将罗丹明染料转化为闭环结构,可快速透膜且背景荧光极低;而与目标蛋白结合之后,染料可转化为开环结构,荧光信号大幅增强,进而实现高信噪比、免洗活细胞成像(图1)。此类探针命名为MaP探针,(Spirochrome公司商业化名称:SPY探针),可用于标签蛋白(SNAP-tag和HaloTag)、细胞骨架(肌动蛋白和微管蛋白)等特定蛋白的免洗、多色、活细胞STED超分辨成像。
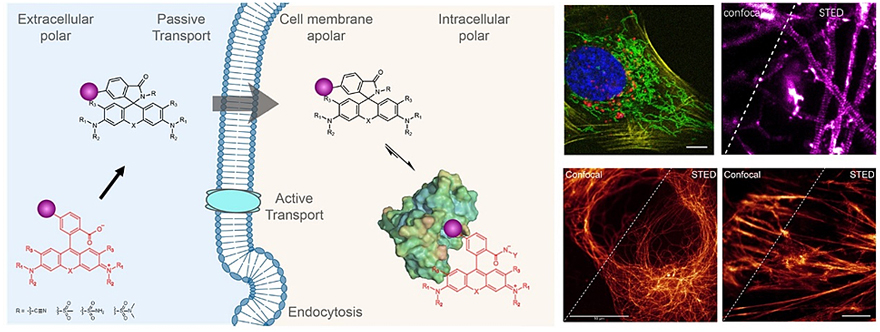
图1. 可用于免洗、多色、活细胞超分辨成像的MaP荧光探针。图片来源:J. Am. Chem. Soc.和Nat. Chem.
近日, Kai Johnsson教授和王璐青年研究员通过引入不同取代的苯磺酰胺以及烷基酰胺,能够更精准、更大范围地调节开闭环结构的平衡。在基本不改变染料光学性质的基础上,通过调节开闭环结构的比例,以满足不同蛋白标记、不同超分辨显微成像技术的特定需要。
基于罗丹明500R染料,引入不同苯磺酰胺结构,精确调节开闭环结构的平衡,进而调节细胞内目标蛋白和背景荧光信号的相对比值,实现免洗条件下活细胞内高信噪比成像(图2)。
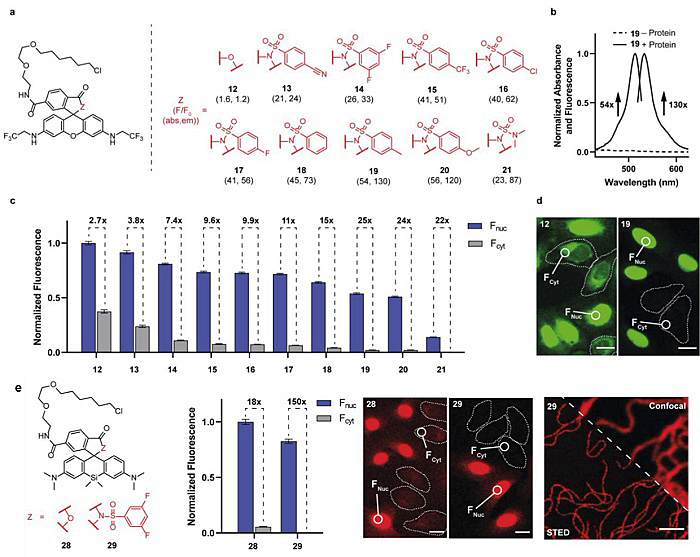
图2. 精确调节开闭环结构的平衡,实现细胞内高信噪比免洗成像。图片来源:J. Am. Chem. Soc.
而通过引入给电子能力更强的烷基酰胺的结构,可使罗丹明类染料大部分处于无荧光螺内酯结构,仅少数分子发射荧光信号。同时,此类染料由于动态平衡过程可产生自闪烁荧光信号,因而可用于微管蛋白和核孔结构的单分子定位超分辨成像(SMLM)(图3)。
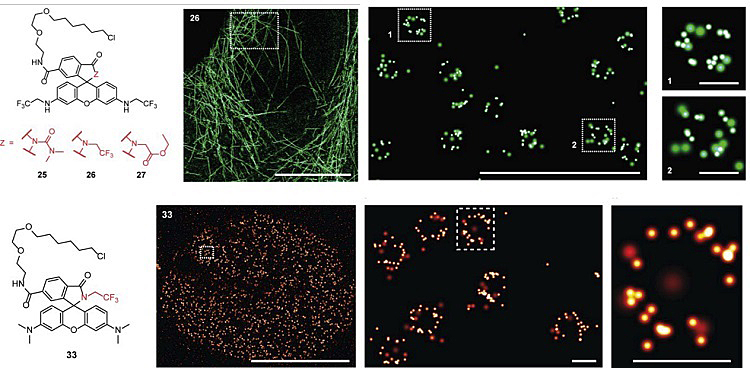
图3. 调节两性离子与螺内酯结构的比例,构建自闪烁荧光探针用于SMLM超分辨成像。图片来源:J. Am. Chem. Soc.
这种调节策略具有普适性,已被成功应用于优化不同波长的罗丹明类染料(如硅罗丹明和碳罗丹明等),实现STED和SMLM超分辨成像研究。相关研究成果近期发表在JACS 上,文章的第一作者是马克斯普朗克医学研究所博士生Nicolas Lardon,通讯作者为Kai Johnsson教授和王璐青年研究员。该工作得到了马克斯普朗克学会、德国研究联合会及德国洪堡研究基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Systematic Tuning of Rhodamine Spirocyclization for Super-resolution Microscopy
Nicolas Lardon, Lu Wang*, Aline Tschanz, Philipp Hoess, Mai Tran, Elisa D’Este, Jonas Ries, and Kai Johnsson*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c05004
导师介绍
王璐,复旦大学药学院青年研究员,博士生导师,获得海外高层次引进人才青年项目。研究工作主要聚焦在化学生物学领域分子探针的开发及生物成像和生物传感应用,以第一作者或通讯作者发表SCI论文10余篇,包括Nat. Chem. (1篇), J. Am. Chem. Soc. (4篇)、Angew. Chem. Int. Ed.(2篇) 等。实验室常年招收博士后,欢迎合成化学与化学生物学背景的同事关注与合作!
博士后位置信息
https://www.x-mol.com/groups/luwangfd/positions/15751
Kai Johnsson is Director at the Max Planck Institute for Medical Research, Department of Chemical Biology since 2017. He was appointed after being Full Professor at the Institute of Chemical Sciences and Engineering of the École Polytechnique Fédérale de Lausanne (EPFL) and co-director of the NCCR Chemical Biology. His current research interests are the development and application of chemical approaches to study and manipulate protein function. His past achievements include the introduction of different approaches to specifically label proteins in living cells; among these the SNAP-tag and CLIP-tag have become popular in the biological community.
Kai Johnsson is Executive Editor of the Journal of the American Chemical Society since 2021. He is member of the Editorial Advisory Board of Science and of the Research Council of the Swiss National Science Foundation. He is co-founder of Covalys Biosciences which was based on protein labeling technologies developed in his laboratory; these technologies are now available through New England BioLabs. He received the Prix APLE for the invention of the year 2003 of EPFL, the Novartis Lectureship Award 2012/13, the Karl-Heinz Beckurts Prize 2016 and is elected member of EMBO.
https://www.mr.mpg.de/13990857/curriculum-vitae
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号