Nano Lett.┃纳米递送策略精准调控胆汁酸信号通路激活肝癌免疫治疗
英文原题:Manipulating Liver Bile Acid Signaling by Nanodelivery of Bile Acid Receptor Modulators for Liver Cancer Immunotherapy

通讯作者:宋万通,中国科学院长春应用化学研究所;黄力夫,北卡罗来纳大学教堂山分校
作者: Guofeng Ji (吉国锋), Xinghui Si (司星辉), Si Dong (董思), Yajun Xu (徐亚军), Mingqiang Li (李明强), Bo Yang, Zhaohui Tang (汤朝晖), Xuedong Fang (房学东), Leaf Huang (黄力夫), Wantong Song (宋万通), Xuesi Chen (陈学思)
肠道菌群能够影响肝脏免疫微环境以及肝癌的治疗效果,因此,调节肠道菌群可作为一种新型治疗肝癌的策略。然而,肠道菌群种类和数量庞大,与人体的交互关系极其复杂,直接操纵肠道菌群实现困难。最近的报道发现,肝癌患者的肠道菌群失调以革兰氏阳性细菌增多导致初级胆汁酸到次级胆汁酸转化增多为主要特征,而在小鼠肝癌模型中,通过抗生素治疗可以调节初级胆汁酸和次级胆汁酸的平衡,起到显著控制肝癌进展的效果。然而,由于安全性和机制不明确,尤其是系统性大剂量使用抗生素后引起的继发性的肠道菌群失调带来的不可预知的风险,使用抗生素来直接治疗肝癌在临床上显然并不现实。
近日,中科院长春应化所陈学思院士、宋万通副研究员和北卡罗来纳大学教堂山分校黄力夫教授在Nano Letters 上发表了利用纳米载体递送胆汁酸受体调节剂以调控胆汁酸信号通路和用于肝癌免疫治疗研究。基于肝癌患者出现的初级胆汁酸和次级胆汁酸失衡的现状,提出通过纳米递送策略对肝脏中的初级和次级胆汁酸受体进行精准调控,绕过对复杂的肠道菌群的直接调控,在肝癌治疗中诱导出强大而高效的抗种瘤免疫效应。
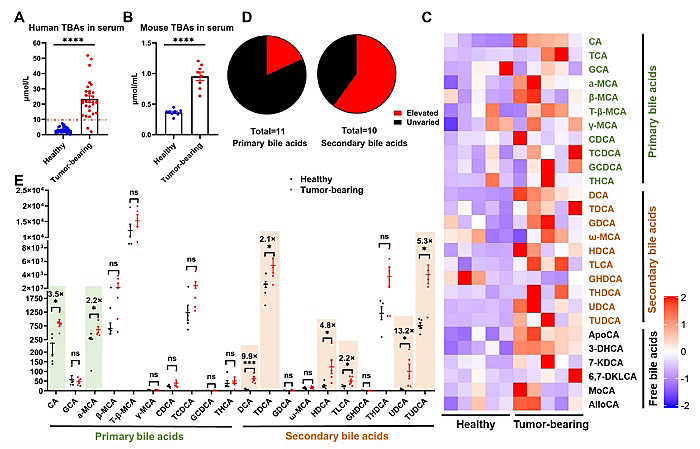
图1. 肝癌患者和荷瘤小鼠的胆汁酸变化分析。(A)原发性肝癌患者血清总胆汁酸(TBAs)水平。(B) 原位H22荷瘤小鼠血清TBAs的水平。(C-D)原位荷瘤小鼠的肝胆汁酸谱变化。
在临床实践中,血清胆汁酸是肝癌进展和预后的重要标志物。在本研究中也观察到肝癌患者和原位H22荷瘤小鼠的血清中总胆酸水平明显高于健康个体。为此,研究团队通过胆汁酸代谢组学分析了荷瘤小鼠肝脏中胆汁酸谱(11种初级胆汁酸、10种次级胆汁酸和6种游离胆汁酸)的改变。与健康小鼠相比,荷瘤小鼠肝脏中的11种初级胆汁酸中只有2种显著增加,而10种次级胆汁酸中有6种显著增加。考虑到初级和次级胆汁酸平衡的重要性及其受体在肝癌发生中的重要作用,作者认为使用法尼醇受体 (Farnesoid X receptor, FXR,主要的初级胆汁酸受体) 的激动剂或G蛋白偶联胆汁酸受体1 (G-protein-coupled bile acid receptor 1, GPBAR1,主要的次级胆汁酸受体)的拮抗剂可能是治疗肝癌的一种潜在选择。考虑到FXR和GPBAR1广泛分布于胃肠道,而肝脏Kupffer细胞和肝窦内皮细胞(liver sinusoidal endothelial cells, LSECs)是清除纳米粒子的主要细胞,作者提出了一种基于聚恶唑啉的纳米递送系统,将FXR激动剂奥贝胆酸(OCA)和GPBAR1拮抗剂5β-CA精准递送到肝脏组织,以最大限度地减少这些胆酸调节剂的不良影响。

图2. 负载OCA和5β-CA纳米颗粒的制备与表征。(A) 通过自组装制备OCA-NPs和5β-CA-NPs。(B) OCA-NPs和5β-CA-NPs水溶液照片。(C) OCA-NPs和5β-CA-NPs的粒径。(D) OCA-NPs和5β-CA-NPs代表性TEM图像。 (E) OCA-NPs体外释放结果。
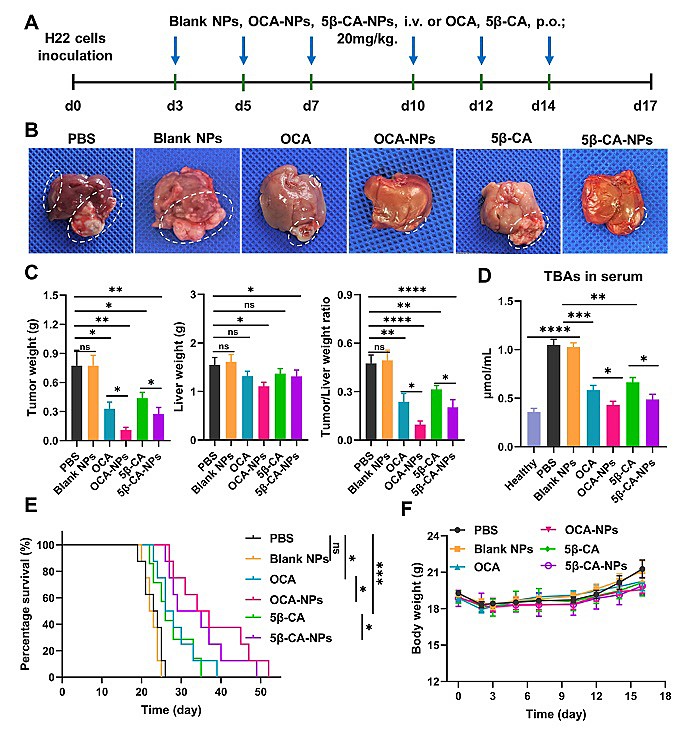
图3. (A)治疗方案。 (B)各治疗组小鼠肝脏的代表性照片。肿瘤用白色虚线勾勒。(C)各治疗组小鼠肝脏肿瘤重量、肝脏重量、肿瘤/肝脏重量比。(D)健康和治疗后小鼠血清总胆汁酸(TBAs)水平。(E) 各治疗组小鼠无病生存率。(F)不同治疗组小鼠体重改变。
研究团队构建了小鼠原位H22肝癌模型评估OCA-NPs和5β-CA-NPs的抑瘤效果。结果显示,OCA-NPs和5β-CA-NPs治疗取得了显著的抑瘤效果,生存期得到了显著的延长,而且OCA-NPs和5β-CA-NPs治疗效果显著优于相对应的小分子药。重要的是,经OCA-NPs和5β-CA-NPs治疗后,小鼠的肝脏中的初级胆汁酸和次级胆汁酸水平几乎回到正常水平。进一步对肝脏免疫微环境进行分析,原位肿瘤和肝脏组织中重要免疫效应细胞如NKT细胞、NK细胞、CD4+和CD8+T细胞浸润数量均显著增加。

图4. 初级和次级胆汁酸、OCA和5β-CA对小鼠和患者肝癌组织中趋化因子分泌影响的体外单因素分析结果。
此外,研究团队还设计了一个单因素实验,以阐明初级和次级胆汁酸、OCA和5β-CA对小鼠和肝癌患者的体外肿瘤组织中关键趋化因子分泌的直接影响。结果显示,OCA对CXCL16/9/10的分泌具有较强的刺激活性,5β-CA则显著逆转了次级胆汁酸 (DCA和LCA) 减少CXCL16/9/10分泌的作用。这些结果证实了初级胆汁酸和次级胆汁酸在人体内可能具有与小鼠上相似的作用,可以通过影响肝脏组织中CXCL16/9/10等趋化因子的分泌而激发强大的抗肿瘤免疫反应,从而控制肝癌生长。
肝脏高度免疫耐受的环境和严格控制的自我保护机制使得肝癌免疫治疗响应性极低,免疫治疗应用前景黯淡。该研究发现调控胆汁酸受体信号可以有效激活肝脏抗肿瘤免疫,招募活化的NKT和T细胞杀灭肿瘤细胞,为肝癌的免疫调控提供了一种新的思路。与此同时,借助于制备的纳米剂型高效递送优势,用药剂量小,安全性极高,有效避免了其他治疗手段诱发的肝衰竭和死亡风险。该方案可能是一种很有前景的用于肝癌免疫治疗的策略,具有很好的临床实践价值。
相关论文发表在Nano Letters 上,吉林大学外科学博士、首都医科大学宣武医院普外科医师吉国锋为文章的第一作者,宋万通副研究员和黄力夫教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Manipulating Liver Bile Acid Signaling by Nanodelivery of Bile Acid Receptor Modulators for Liver Cancer Immunotherapy
Guofeng Ji, Xinghui Si, Si Dong, Yajun Xu, Mingqiang Li, Bo Yang, Zhaohui Tang, Xuedong Fang, Leaf Huang*, Wantong Song*, and Xuesi Chen
Nano Lett., 2021, 21, 16, 6781–6791, DOI: 10.1021/acs.nanolett.1c01360
Publication Date: August 12, 2021
Copyright © 2021 American Chemical Society
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

































 京公网安备 11010802027423号
京公网安备 11010802027423号