ACS Nano┃脂质纳米粒——从脂质体到mRNA疫苗递送,研究多样性及进展概览
脂质纳米粒(lipid nanoparticles, LNPs)作为非常有前景的多种治疗剂载体,在制药行业已备受关注。尤其是当下,LNPs是抗击新冠(COVID-19)疫情的重要武器——mRNA疫苗的关键成分,在有效保护mRNA并将其运输到细胞当中发挥着举足轻重的作用。同时,LNPs的应用也扩展到了其他领域,比如医学影像、化妆品、营养品、农业以及纳米反应器等等。脂质体是最早出现的一类LNPs,可以运输疏水或亲水分子,包括小分子、蛋白质和核酸,是一种用途极为广泛的纳米载体平台。事实上,脂质体也是最早一类成功实现从概念到临床应用转化的纳米药物递送平台,许多脂质体药物制剂已获批上市并成功应用于医疗实践。新一代LNPs,包括固体脂质纳米粒、纳米结构脂质载体和阳离子脂质-核酸复合物,表现出更复杂的内部结构和更优秀的物理稳定性。LNPs能够控制体内药物递送的靶向位置和时间,可为多种疾病提供治疗方案。
近期,美国化学文摘社(CAS)的Rumiana Tenchov博士等人在ACS Nano 发表综述文章,基于对“CAS Content Collection”的分析,展示了与LNPs相关的科学出版物(包括专利和期刊文章)的概况。他们从药物应用的角度概述了当前有关LNPs结构和性质的知识;明确了当前的研究趋势,例如纳米结构的脂质载体和固体脂质纳米粒成为众多配方的首选平台;讨论了LNPs制剂作为药物递送平台的最新进展,例如抗肿瘤和核酸疗法以及疫苗递送系统;还评估了LNPs在其他领域的挑战和增长机会,例如医学影像、化妆品、营养和农用化学品。作者希望为那些对LNPs纳米技术、其应用和全球研究工作感兴趣的人提供有用的资源。
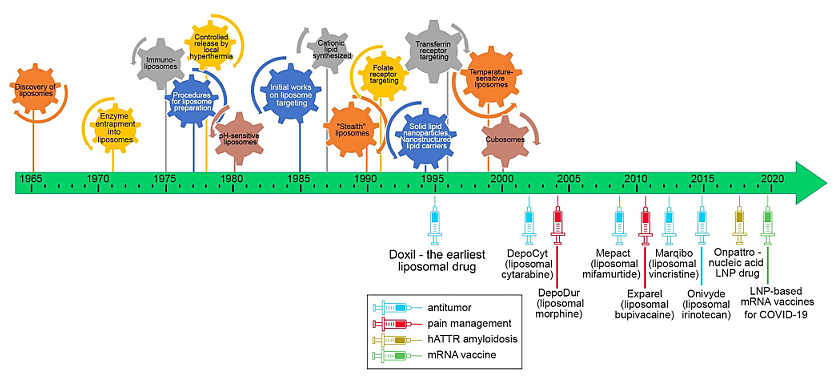
图1. 脂质体/LNPs发展的时间线。
脂质纳米粒的基本知识
脂质体——最早出现的脂质纳米粒
“脂质体”一词出现于上世纪六十年代,当时发现封闭的脂质双层囊泡能在水中自发形成(图2A)。“脂质纳米粒”一词的出现要晚不少,约在上世纪九十年代早期,也就是纳米科学技术开始的时期。
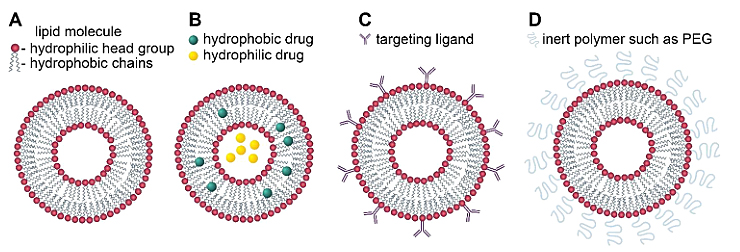
图2. 示意图。(A) 脂质体、(B) 包裹疏水性和亲水性药物的脂质体、(C) 用靶向配体功能化的免疫脂质体、(D) 用惰性聚合物(如PEG)功能化的空间稳定(“隐形”)脂质体。
脂质体被发现后不久,研究者就发现它有潜力用作药物递送系统。脂质体由一个或几个脂质双层组成,大小在 20 nm到 1000 nm 之间,亲水性药物可以封闭在脂质体的水性内部区域,而疏水性药物可以包裹在脂双层的烃链区域中(图2B)。举个例子,已知超过40%治疗癌症的小分子药物在水中溶解度低,而脂质体作为药物递送系统能够封装这些药物并提高其水溶性。脂质体也是最早成功实现从概念到临床应用转化的纳米药物递送平台。最早获批的脂质体药物是Doxil,一种用于治疗卵巢癌的抗肿瘤药物阿霉素的脂质纳米粒制剂。脂质体如今已被用于许多临床试验,作为抗癌、抗炎、抗生素、抗真菌、麻醉剂和其他药物和基因疗法的递送系统。
脂质体的结构很大程度上取决于制备方式。脂质体可以是单层囊泡以及多层囊泡。尺寸大小是决定脂质体药物包封和循环半衰期的关键参数,较小的脂质体有更多的机会逃脱吞噬细胞的摄取。人们普遍认为,药用脂质体,尤其是用于肠胃外给药的情况下,颗粒尺寸一般不大于100 nm。LNPs的粒径分布可以通过挤压、超声和均质等制造方法进行控制,最近,微流体方法已成功用于LNPs制造和尺寸控制。LNPs的表面电荷通常由脂质头部基团决定,它可以带正电或负电或两性离子。取决于表面电荷密度的表面电位控制着颗粒之间的相互作用和抗衡离子的吸附,从而控制着纳米颗粒的稳定性。不带电颗粒或低电荷密度的颗粒会随着时间的推移而聚集,而电荷密度较高的颗粒会相互排斥,从而阻止聚集。
阳离子脂质-核酸复合物
核酸在医学中具有多种作用,包括基因治疗剂和RNA治疗剂。然而,核酸带负电荷且呈亲水性,阻碍了它们跨质膜的被动扩散;此外,核酸可与血清蛋白结合,可被吞噬细胞吞噬,还会被内源性核酸酶降解。因此,核酸需要递送载体来保护它们免于降解并将它们递送至靶细胞以内进行有效摄取。包含合成阳离子脂质和阴离子核酸的稳定复合物的阳离子LNPs,是使用最广泛的核酸药物非病毒递送系统。阳离子脂质的分子结构类似于天然脂质的分子结构,不同之处在于前者包含可离子化(阳离子)头部基团,而后者包含两性离子或阴离子头部基团。与带正电荷的脂质复合可稳定核酸并增加其对核酸酶降解的抵抗力(图3),使其能够被递送到所需的靶细胞。LNPs吸附到细胞表面,然后进行内吞作用并将核酸释放到细胞中。一旦核酸进入细胞,细胞的阴离子脂质可能通过中和其阳离子脂质载体的电荷,破坏脂质载体与核酸之间的静电相互作用,帮助从 LNPs中释放核酸。
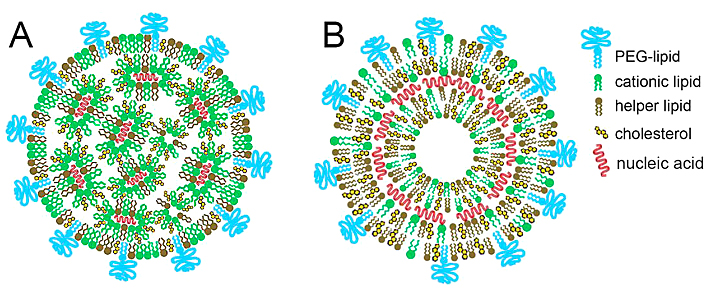
图3. 脂质纳米粒核酸载体的结构:(A) 核酸在纳米颗粒内部以反向脂质胶束组织;(B) 核酸夹在脂质双层之间
固体脂质纳米粒和纳米结构脂质载体
脂质体虽可用作药物载体,但也存在不少问题,比如生产方法复杂且需要使用有机溶剂、药物包埋效率低、难以扩大规模等。于是,研究者开发了固体脂质纳米粒(SLN)和纳米结构脂质载体(NLC)以解决其中一些问题。传统脂质体包含液晶脂质双层,而SLN包含固体脂质,NLC包含固体和液晶脂质的混合物。SLN和NLC的粒径通常在40 nm至~1000 nm 之间。SLN和NLC表现出更好的物理稳定性,解决了基于脂质体制剂的一个主要问题。SLN和NLC还具有更高的负载能力和更高的生物利用度,易于大规模生产,无需使用有机溶剂,并且比其他 LNP相比经历灭菌时更稳定。此外,由于较低的固态分子流动性,SLN和NLC能够更精确地控制其药物有效载荷的释放。然而,在长期储存中,SLN的结晶可能将负载药物排出到周围的介质中。通过在室温下将少量脂质液体引入SLN来设计NLC,可降低脂质核心的结晶度,抑制药物从基质中的排出,增强了纳米颗粒的载药能力和长期物理化学稳定性。
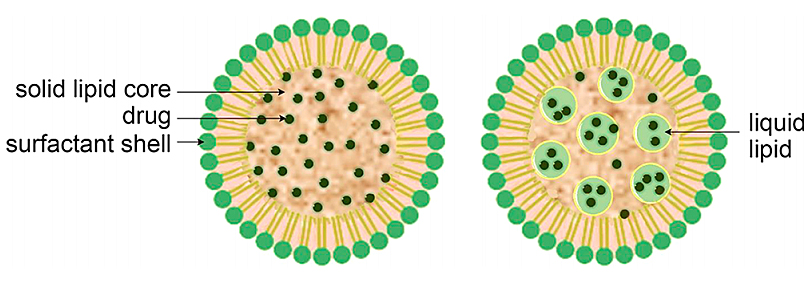
图4. 固体脂质纳米粒(左)和纳米结构脂质载体(右)示意图。
非层状脂质纳米粒
其他类型的LNP结构也已被研究用于药物递送,比如上世纪八十年代就有报道使用非层状脂质相进行药物递送,以及在用于递送吸入药物的控释制剂中使用倒立方和六角液晶相。最近,立方脂质体(cubosomes),一种由脂质立方相形成并由基于聚合物的外冠稳定的纳米颗粒,被开发为高度稳定的脂质药物纳米载体(图5)。与脂质体相比,立方脂质体为负载膜蛋白和小分子药物提供了更高的膜表面面积。立方脂质体的性质使其适合多种应用,例如药物递送系统、膜生物反应器、人工细胞和生物传感器等。六角脂质体(hexosomes)是另一种类型的LNP,其中脂质形成非层状相——倒六角相HII。组成类似于立方脂质体,包含两亲性脂质、聚合物稳定剂和水。胶束是具有疏水核和亲水壳的非层状脂质纳米粒,已成功用于溶解难溶于水的药物。
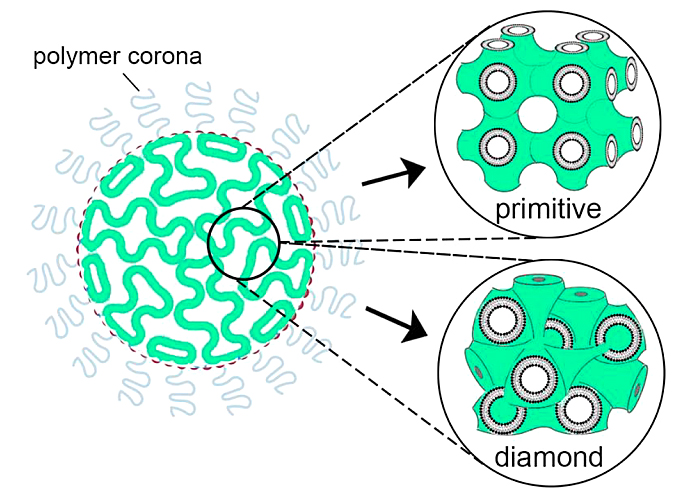
图5. 立方脂质体结构示意图。
含醇脂质体和声学脂质体
含醇脂质体(ethosomes)是含有高比例(20-45%)乙醇的磷脂纳米颗粒。添加乙醇增加了含醇脂质体的渗透性和弹性,使它们能够通过挤压皮肤毛孔来进行药物和化妆品的透皮递送。这提供了一种替代递送方法,避免了胃肠道在口服给药时引起的并发症。声学脂质体(echogenic liposomes)是用作超声造影剂的声学活性脂质体。封装在脂质体中的微气泡可增强医学声学成像。声学脂质体也可用于治疗,例如超声控制药物递送和超声增强溶栓。
LNPs的功能修饰
未经修饰的LNP药物递送系统具有明显的局限性,例如缺乏靶向选择性、血液循环时间短和体内稳定性差。对LNPs的功能修饰旨在克服这些局限,常用的策略包括:靶向脂质体、“隐形”脂质体、刺激响应性脂质体。
靶向脂质体(图2C),具有表面附着的配体以识别并结合细胞上的特定受体。通常情况下,靶向脂质体是通过将小分子配体、肽或单克隆抗体结合到LNP 表面来制备的。例如,用IgM配体修饰的脂质体的效率比未修饰的脂质体高 100 倍。LNP 靶向中使用的配体示例如下表 所示。

虽然免疫脂质体对特定细胞类型具有高度选择性,但它们会被吞噬细胞迅速去除。为了解决这个问题,脂质体外修饰生物相容性惰性聚合物,通常是聚乙二醇(PEG),使它们对吞噬细胞不可见,就得到了“隐形”脂质体(图2D)。当暴露于物理化学或生化刺激时,刺激响应性脂质体能够可控地释放包封药物。这种药物递送系统响应特定的触发因素,在需要的地方释放药物,提高疗效并减少不良反应。目前已经研究了对温度、pH值变化、酶、光、磁场、电场以及超声波响应的脂质体。在这些刺激因素中,由于体内存在多个pH梯度,pH变化是最有希望的一个。当受到刺激触发时,LNPs会发生相变从而增加膜渗透性。刺激响应脂质体的例子如下表所示。

LNPs制剂中所用脂质的毒性
由于LNPs主要由天然脂质组成,因此被认为在药理学上无活性且毒性很低。然而,在某些情况下,当包含可能对人体细胞有毒的非天然化合物时,LNPs在免疫学上并非没有活性。例如,虽然阳离子脂质作为递送易失活化合物(如核酸)的载体备受关注,但一些阳离子脂质会导致细胞毒性。在某些情况下,阳离子脂质会减少细胞的有丝分裂,在细胞质中形成液泡,并对蛋白激酶C等关键细胞蛋白质产生不利影响。
脂质纳米粒的应用
药物和疫苗递送
半个多世纪以来,脂质体一直被认为是医学的强大工具,能够将治疗药物可控地封装并输送到体内特定位置,这使得它们可用于治疗各种疾病。许多LNPs药物制剂已获批上市并用于医疗实践(图6)。根据最近的市场分析以及基于LNPs的已上市药物信息,全球脂质体药物递送市场的主要参与者如图7所示。
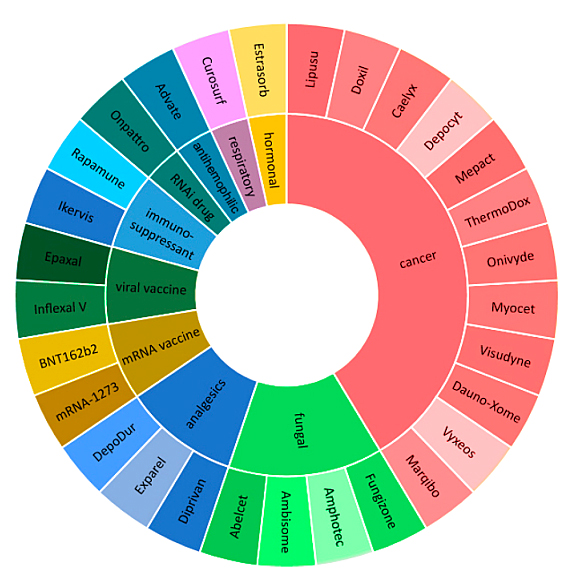
图6. 已上市LNP药物及相关疾病
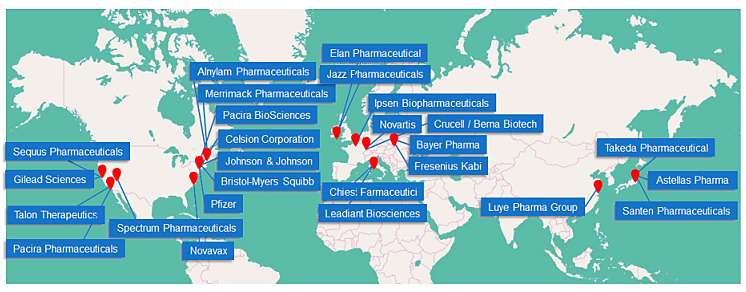
图7. 全球脂质体药物递送市场的主要参与者
LNPs在药物递送中的最大单一应用是癌症治疗,这是因为LNP封装的抗肿瘤药物比游离药物具有更高的生物利用度和选择性。基于脂质的纳米载体可降低抗癌药物对正常组织的毒性,增加疏水性药物的水溶性,延长药物停留时间,改善对药物释放的控制。第二大类脂质体药物是杀真菌剂。目前最受关注的脂质体药物无疑是核酸类脂质体药物,LNP载体是递送核酸药物的成功方法之一。核酸药物 Patisiran (ONPATTRO),一种在LNP负载的siRNA药物,可减少肝脏中转甲状腺素蛋白的形成,最近获得FDA批准用于治疗遗传性转甲状腺素蛋白介导的淀粉样变性。它是最早获批的siRNA药物和LNP制剂核酸药物,被视作核酸疗法发展的重要里程碑。
近来,LNPs最受关注的成功应用无疑是作为辉瑞/BioNTech以及Moderna两种COVID-19 mRNA疫苗的递送载体。疫苗将编码 SARS-CoV-2 刺突蛋白的mRNA传递到宿主细胞的细胞质中,mRNA被翻译成刺突蛋白,作为抗原诱导针对病毒的免疫反应。两种mRNA疫苗LNP载体的脂质成分及结构如下表及图8所示。当然,由LNPs作为递送载体的mRNA疫苗不光可以用于预防COVID-19,还可以用类似技术开发针对多种疾病的mRNA疫苗,比如狂犬病、流感等。

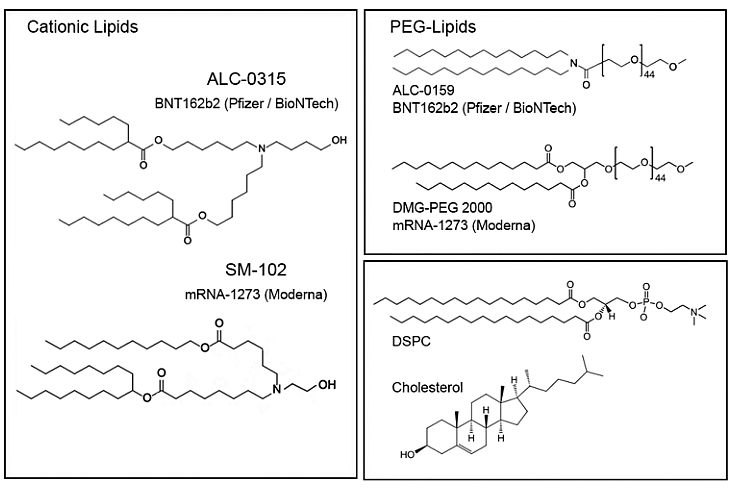
图8. 两种mRNA疫苗LNP载体的脂质成分的结构
LNPs其他应用
LNPs还可用于医学影像。传统的成像方法,如磁共振成像(MRI)、计算机断层扫描(CT)、正电子发射断层扫描(PET)和单光子发射计算机断层扫描(SPECT),分辨率和特异性有限。LNPs等纳米粒子传递系统及其多功能表面功能化为提高这些成像方法的分辨率和特异性提供了机会。在医学之外,LNPs还可用于化妆品、营养品、农用化学品、纳米反应器等,还可作为膜模型用于基础科学研究。
基于“CAS Content Collection”的LNP研究概览
在文章后半部分,作者基于“CAS Content Collection”对当前的LNP研究进行了概览,对与LNPs相关的所有文献进行了分类和量化。目前,“CAS Content Collection”中有超过216,000篇与LNPs相关的科学出版物,包括专利和非专利(期刊文章、书籍、论文、会议摘要等),其中超过170,000篇来自2000-2020年。截至2021年6月,“CAS Content Collection”中有超过45,000项与LNPs/脂质体相关的专利,其中超过41,000项来自2000-2021年,大多数LNP专利的发明人来自美国和中国。
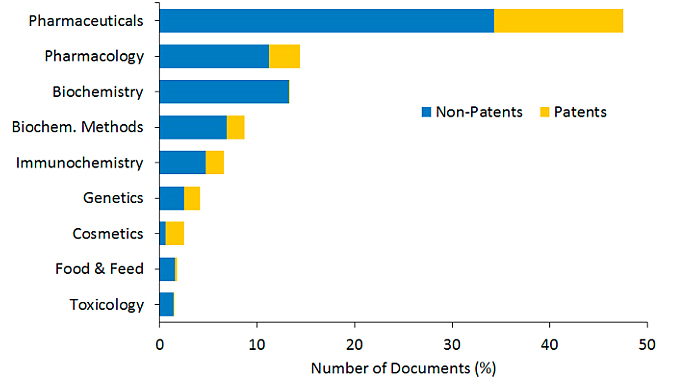
图9. 2000-2021年“ CAS Content Collection”各领域中LNP相关文献的分布
根据对“CAS Content Collection”中 LNP相关文献的景观分析,在为LNPs制剂选择脂质成分时作者建议以下方面可能值得考虑:(1)生物相容性。优选天然脂质,使用最广泛的脂质是磷脂。(2)流动性。胆固醇能调节脂质双层的流动性,提高固体双层的流动性,降低液体双层的流动性。它也是生物膜的主要成分之一,具有高度的生物相容性。(3)相态和相变温度。相态与LNPs的稳定性和封装效率有关,并控制与生物膜的相互作用和内容物释放。(4)电荷(zeta电位)。LNP所带电荷会影响其稳定性、内容物释放速率、血液中的循环半衰期以及生物膜相互作用。(5)毒性。毒性与包含人工合成阳离子脂质的制剂尤其相关。(6)颗粒大小。大小是决定 LNP 循环半衰期和药物包封的关键参数,而LNP的大小很大程度上取决于它们的制备方式。(7)循环时间和吞噬细胞摄取。用惰性聚合物(如PEG)涂覆LNPs可显著延长其在血液循环中的停留时间。(8)内容物释放。LNPs需要足够稳定以安全地将内容物运送到目标,同时又能够及时分解离析以在所需位置释放内容物。在许多情况下,外部刺激可用于促进药物释放,例如pH值变化。(9)封装效率和稳定性。用固体脂质纳米粒或特别是纳米结构脂质载体代替传统的脂质体制剂可以显著提高脂质纳米载体的稳定性和封装效率。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看介绍):

Lipid Nanoparticles—From Liposomes to mRNA Vaccine Delivery, a Landscape of Research Diversity and Advancement
Rumiana Tenchov, Robert Bird, Allison E. Curtze, and Qiongqiong Zhou*
ACS Nano, 2021, DOI: 10.1021/acsnano.1c04996
Publication Date: June 28, 2021
Copyright © 2021 American Chemical Society
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号