Nano Lett.┃结合诱导纤维化多肽识别并阻断细胞内波形蛋白骨架化抑制乳腺癌
英文原题:Binding-Induced Fibrillogenesis Peptides Recognize and Block Intracellular Vimentin Skeletonization against Breast Cancer

通讯作者:王磊研究员,国家纳米科学中心;李香丹教授,中南民族大学
作者:Jia-Qi Fan, Yi-Jing Li, Zi-Jin Wei, Yu Fan, Xiang-Dan Li, Zi-Ming Chen, Da-Yong Hou, Wu-Yi Xiao, Meng-Ru Ding, Hao Wang, and Lei Wang
自组装是构建和调节生命的自然特征之一。例如,微管蛋白自组装成微管作为活细胞的骨架结构;人表皮生长因子受体2(Her2)在乳腺癌细胞表面自组装二聚体,加速肿瘤细胞增殖和迁移;纤连蛋白 (FN) 作为细胞外基质 (ECM) 的一部分自组装成纤维网络,调控细胞的粘附、迁移、吞噬等。
与成熟的化疗药物相比,抗转移药物需求巨大。一方面,包括多肽在内的聚合物材料在治疗肿瘤生长和转移方面表现出很大的优势。另一方面,许多与转移相关的新靶点正在逐渐被发现。其中,骨架蛋白波形蛋白显著增强了肿瘤细胞的迁移、侵袭和转移。波形蛋白的过度表达和不当的自组装使肿瘤细胞的形态改变和运动性增加。
FN的自组装是由FN与细胞表面受体整合素的结合引发的,具体而言,FN中RGD序列的羧基与整合素的金属离子依赖性粘附位点(MIDAS)中的Ca2+之间的配位,扰乱FN的疏水-亲水平衡并导致 FN 的构象转变。随后,FN 暴露自组装序列并自组装成纤维结构。整个过程被成为结合诱导成纤维(Binding-Induced Fibrillogenesis,BIF)。王磊研究员专注于设计模拟 FN 的BIF多肽,并在体内原位在细胞表面构建纤维网络。由于BIF多肽可以通过结合细胞表面的蛋白质受体,调节受体的组装来实现,前期工作中BIF多肽实现了通过抑制受体蛋白的二聚化(细胞表面的Her2)等等来实现其功能性。
在此研究中,国家纳米科学中心联合中南民族大学设计了一种针对于波形蛋白的BIF多肽,该多肽可以在原位形成纤维网络,阻断波形蛋白不当的自组装以抑制肿瘤转移。BIF多肽可以与波形蛋白结合,随后进行原纤维生成以在波形蛋白上形成纤维。由此产生的多肽纤维网络阻止波形蛋白骨架化并抑制肿瘤细胞的迁移和侵袭。在肿瘤转移的小鼠模型中,肿瘤体积和肺转移数量明显减少。此外,BIF多肽(5 mg/Kg)的疗效远优于以小分子抗转移药物withaferin A(5 mg/Kg),表明BIF多肽在阻断细胞内蛋白质自组装方面明显优于小分子抑制剂。
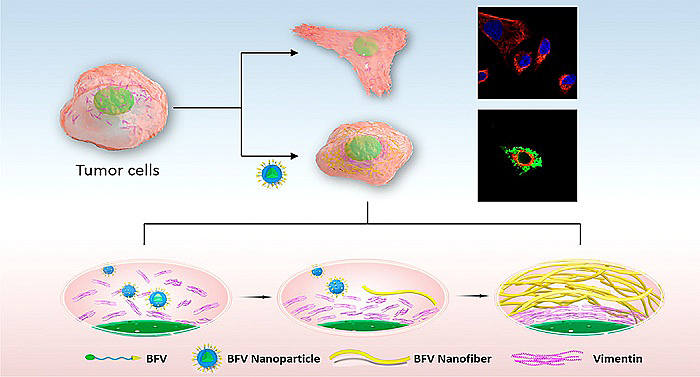
图1. BFV多肽的抑制肿瘤机制示意图
BFV多肽在水环境中由于亲疏水平衡组装形成纳米颗粒,在结合到受体蛋白时,在给受体结合力以及组装片段的共同作用下形变成纤维形态。通过紫外、荧光、TEM、圆二色谱和红外等验证了此过程。
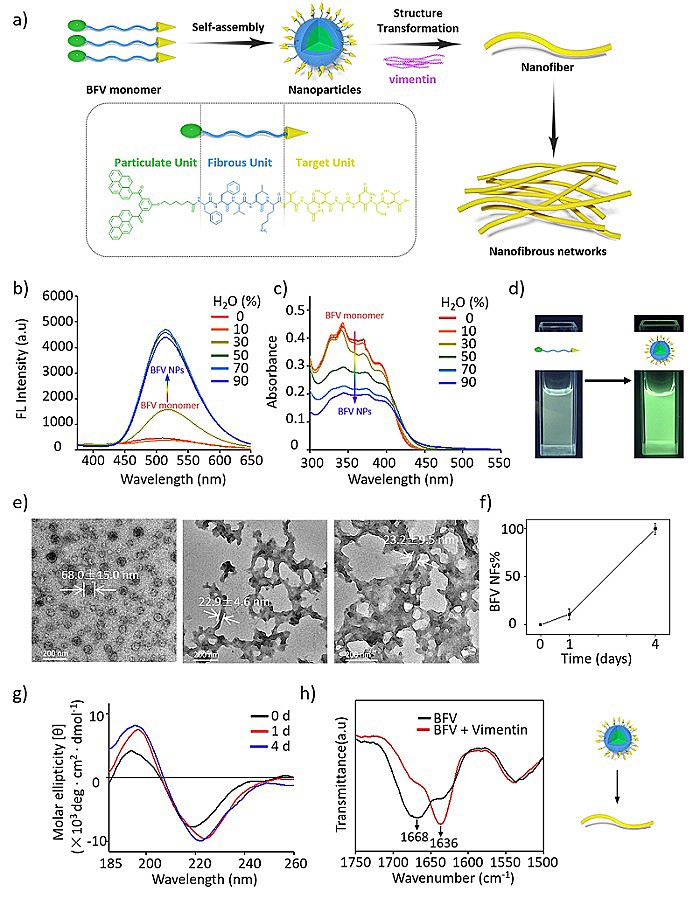
图2. BFV多肽的自组装形变机制示意图及其相关表征
BFV多肽能够在细胞内发生形变,并且调控细胞内的波形蛋白。通过体外细胞划痕实验、Transwell迁移以及侵袭实验,发现BFV能够很好抑制肿瘤细胞的转移能力。
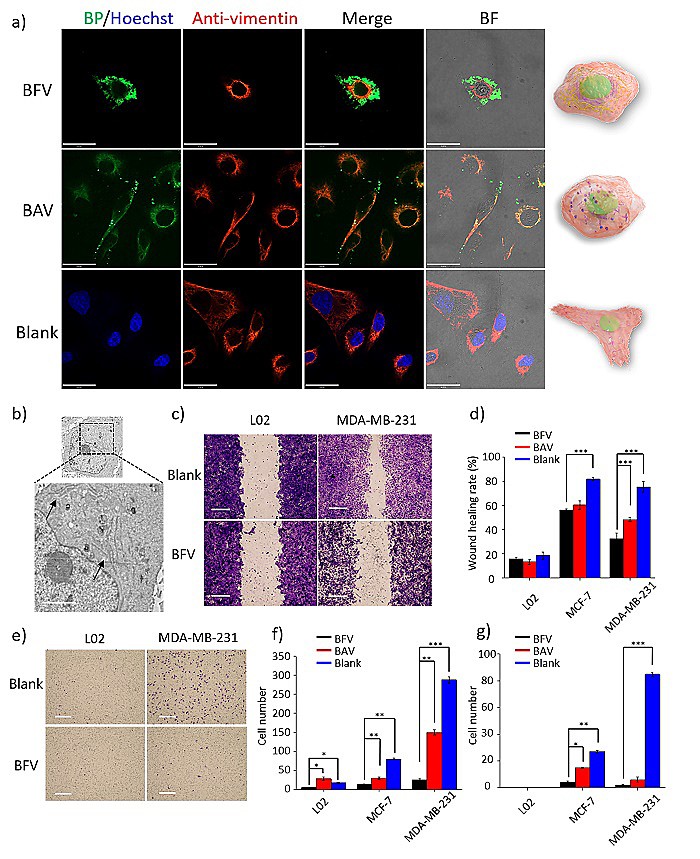
图3. BFV多肽识别、包围并阻断细胞内的波形蛋白,在体外抑制肿瘤细胞的迁移和侵袭
在19天的治疗过程中,BFV多肽对肺转移小鼠模型的肿瘤转移情况进行了很好的抑制。肺部转移结节数量显著下降,原位肿瘤体积明显得到抑制。

图4. 肺转移小鼠模型治疗过程及评价
总之,在前期基础--模拟FN的BIF调节细胞膜蛋白质之上,作者通过 BIF多肽调节细胞内蛋白质的首次概念验证研究。纳米颗粒肽在细胞内靶向蛋白质的成药性方面显示出巨大的潜力,而单抗是无法靶向细胞内的蛋白质的。此外,仿生BIF多肽显示出比小分子抑制剂更高的功效,表明BIF多肽在控制蛋白质组装方面优于小分子。仿生BIF多肽可进一步用于针对不同疾病靶向和调节细胞内的其它蛋白质,并且正在优化该肽以实现细胞的高效内化。
相关论文发表在Nano Letters 上,第一作者为中南民族大学和国家纳米中心联合培养硕士研究生范佳琪,通讯作者为中南民族大学李香丹教授和国家纳米科学中心王磊研究员。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Binding-Induced Fibrillogenesis Peptides Recognize and Block Intracellular Vimentin Skeletonization against Breast Cancer
Jia-Qi Fan, Yi-Jing Li, Zi-Jin Wei, Yu Fan, Xiang-Dan Li*, Zi-Ming Chen, Da-Yong Hou, Wu-Yi Xiao, Meng-Ru Ding, Hao Wang, and Lei Wang*
Nano Lett., 2021, 21, 14, 6202–6210, DOI: 10.1021/acs.nanolett.1c01950
Publication Date: July 14, 2021
Copyright © 2021 American Chemical Society
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号