Nat. Catal.:铜催化与卤原子转移的“组合拳”
含氮化合物不仅具有显著的生物学活性,而且广泛存在于许多天然产物和药物分子中,如抗肿瘤药依鲁替尼、类风湿药Xeljanz和止吐药凯特瑞等(图1a)。通常情况下,这些化合物中都含有C(sp3)-N键,因此如何构建C(sp3)-N键已成为学术界和工业界不可或缺的一部分。尽管氮亲核试剂对卤代烷进行的SN2取代反应是有机化学教学中最先引入的反应之一,但其实际应用仅限于位阻较小(伯)或活化(α-羰基、苄基)的底物(图1b)。相比之下,自由基化学或许是一个不错的选择,特别是铜催化在碳自由基中间体的偶联反应中表现出独特的多功能性(如铜(II)络合物捕获碳自由基的速度很快、高价Cu(III)物种易还原消除)。尽管如此,但铜催化在未活化烷基卤化物的胺化方面却应用有限(图1c)。目前,解决铜催化C(sp3)-N键的构建都依赖于光化学,例如:光诱导胺与烷基卤化物的交叉偶联(Angew. Chem. Int. Ed., 2013, 52, 5129; Science, 2016, 351, 681; Science, 2012, 338, 647);光氧化还原催化胺与烷基自由基前体的交叉偶联(Nat. Catal., 2018, 1, 120; Nature, 2018, 559, 83; Angew. Chem. Int. Ed., 2020, 59, 7921; Science, 2020, 367, 1021; Chem. Sci., 2020, 11, 12822)。
近年来,英国曼彻斯特大学Daniele Leonori教授课题组等证实了α-氨基烷基自由基能够引发卤原子转移(XAT),并从相应的卤代物中获得烷基自由基(图1c,Science, 2020, 367, 1021; Chem. Sci., 2020, 11, 12822; J. Am. Chem. Soc., 2019, 141, 16643; ACS Catal., 2020, 10, 13682),从而实现C-C键的构建。在以上工作基础上,Daniele Leonori教授和同事Fabio Juliá教授等人将α-氨基烷基自由基介导的XAT过程与铜催化完美结合,成功地实现了烷基碘化物(自由基前体)与N-亲核试剂的交叉偶联反应。该反应不仅条件温和、官能团耐受性好,而且还能实现复杂生物活性物质和药物分子的后期官能团化。相关成果发表在Nature Catalysis 上。
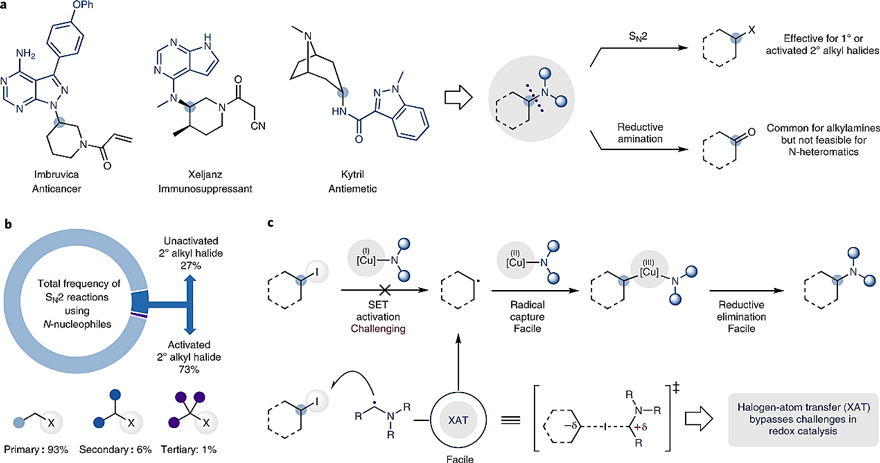
图1. C(sp3)-N键的相关性与构建。图片来源:Nat. Catal.
首先,作者选择4-碘-N-Boc-哌啶1与3-氯吲唑2为模板底物,对XAT-Cu介导的胺化反应进行了设计。如图2a所示,碱辅助的吲唑2与Cu(I)配位得到[Cu(I) -2]配合物A,后者与过氧化物B发生SET过程得到[Cu(II)-2]配合物C和氧自由基D,随后D与烷基胺E发生HAT过程产生α-氨基烷基自由基F,然后F与4-碘-N-Boc-哌啶1发生卤原子转移(XAT)过程,得到烷基自由基G和亚胺H。接着,[Cu(II)-2]配合物C快速捕捉烷基自由基G得到高价 [alkyl–Cu(III)–2]物种I,后者经还原消除便可构建C(sp3)-N键并再生铜(I)催化剂。
为了验证反应机理的准确性,作者以碘化物1和3-氯吲唑2为模板底物对反应条件进行了筛选(图2b),发现在[Cu(CH3CN)4]PF6为催化剂、(nBu)3N为α-氨基烷基自由基前体、cumOOTMS为氧化剂、BTMG为碱(pKa=26.5)、CH3CN-tBuOH为溶剂的条件下于室温反应1 h,能以较高的收率(74%)得到目标产物3,并且还能以克级规模进行制备。对照实验表明铜催化剂、胺、氧化剂和碱四者缺一不可。另外,作者通过竞争实验证明了α-氨基烷基自由基F对C-I键的活化作用。随后,作者使用紫外-可见吸收光谱(UV-vis)来获得铜催化循环中间体的相关信息(图2c),结果表明:(1)[Cu(I)-2]配合物A只有在碱存在下才可以形成;(2)碘代物1与A之间并不反应;(3)[Cu(II)-2]配合物C的形成同样被证明。最后,为了验证铜催化循环的最后一步,作者将过氧化物6与[Cu(II)-2]配合物C进行反应。如图2d所示,7的形成进一步证实了自由基中间体在[Cu(II)-2]配合物C上发生金属化,然后还原消除,最终完成催化循环。
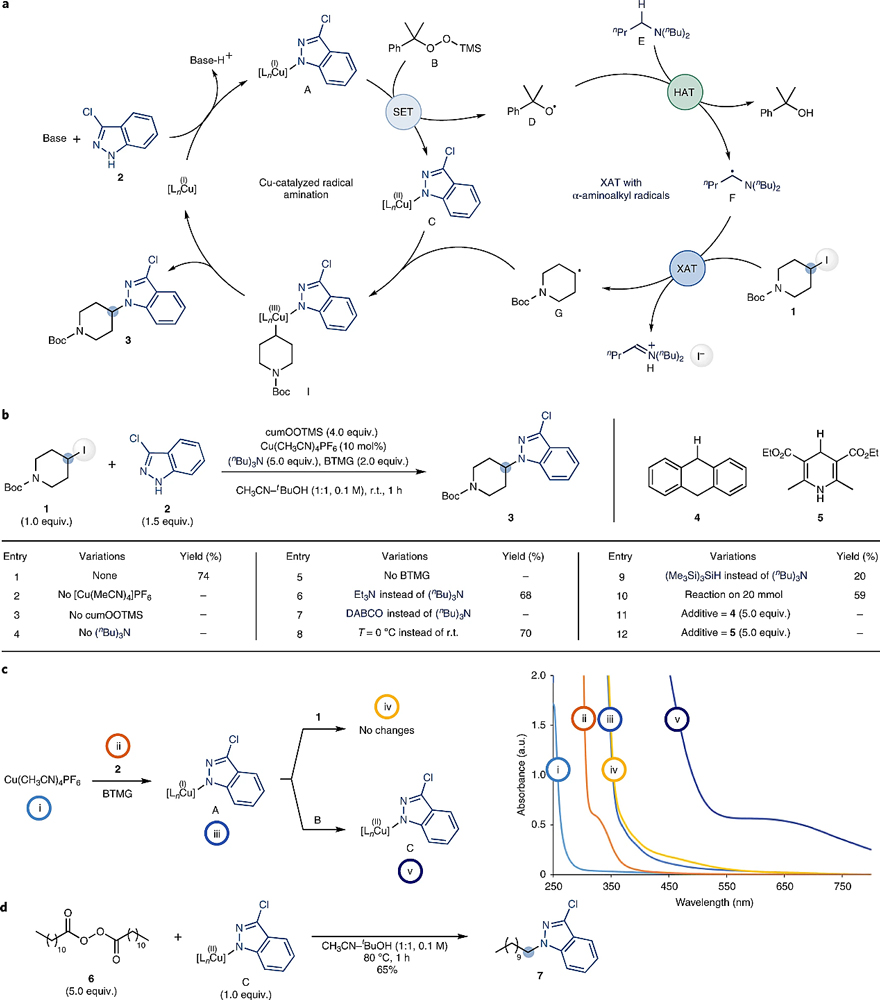
图2. 铜催化与卤原子转移的策略实现烷基碘化物的胺化反应。图片来源:Nat. Catal.
在最优条件下,作者考察了N-亲核试剂的底物范围(图3),结果显示带有不同取代基的吲唑(8-11)和吲哚(12-15)、色氨酸修饰的吲哚(16)、抗肿瘤药物enzastaurin的中间体(17)、咔唑(18)、吡咯(19)以及7-脱氮嘌呤(20)都能兼容该反应,以中等至较好的收率得到目标产物。类似地,不同基团取代的2-氨基杂环类底物(如氨基吡啶类(21-28)、氨基喹啉(29)、氨基嘧啶类(30-32)、氨基吡嗪(33)、2-氨基吡咯并[2,1-f][1,2,4]三嗪(34)等)也能实现这一转化,收率中等。值得一提的是,该方法使烷基碘代物向伯胺的转化成为可能(如35经简单的脱保护便可得到伯胺36)。对于环状酰胺(37、38)而言,也能以中等至优异的收率获得相应的产物。不过,亲核性低的苯基酰胺(39)和苯胺(40)无法有效地参与该反应。
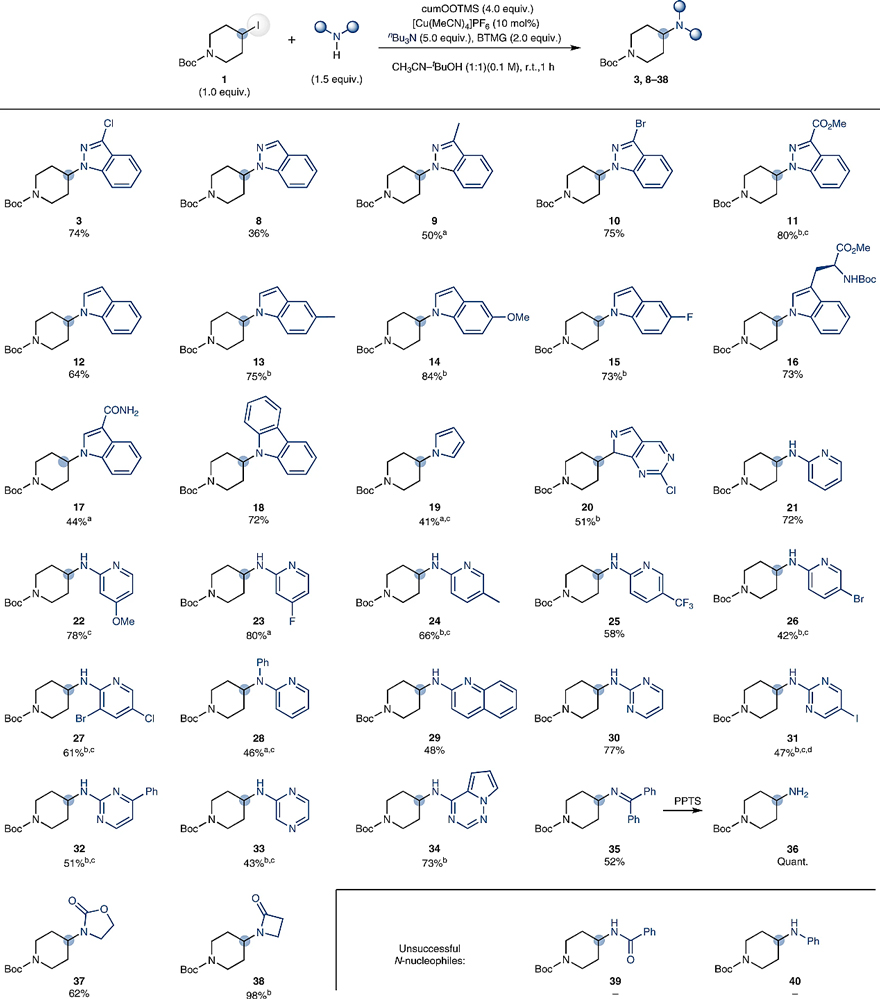
图3. N-亲核试剂的底物探索。图片来源:Nat. Catal.
接下来,作者进一步考察了碘代物的适用范围。如图4所示,环状碘代物(41-44、54-55)、非环状碘代物(45)甚至杂环碘代物(如带有保护基的3-和4-碘哌啶(46、47)、4-碘四氢吡喃(48)、4-碘四氢硫代吡喃(49)、氮杂环丁烷(50)、氧杂环丁烷(51)、螺环骨架(52、53))都能实现胺化反应,以中等至优异的收率(37-96%)得到目标产物。此外,作者采用Appel反应和烯烃碘化反应合成了几种结构复杂的碘代物,它们同样具有很好的兼容性,例如,含有羟基的生物碱去甲托品(56)和3α-胆甾烷衍生的碘代物(57)均可以获得相应的产物;环己烯加成获得的β-碘醚(58)、β-碘氟(59)以及降冰片烯衍生的底物(60)也具有很好的耐受性,尽管收率中等。
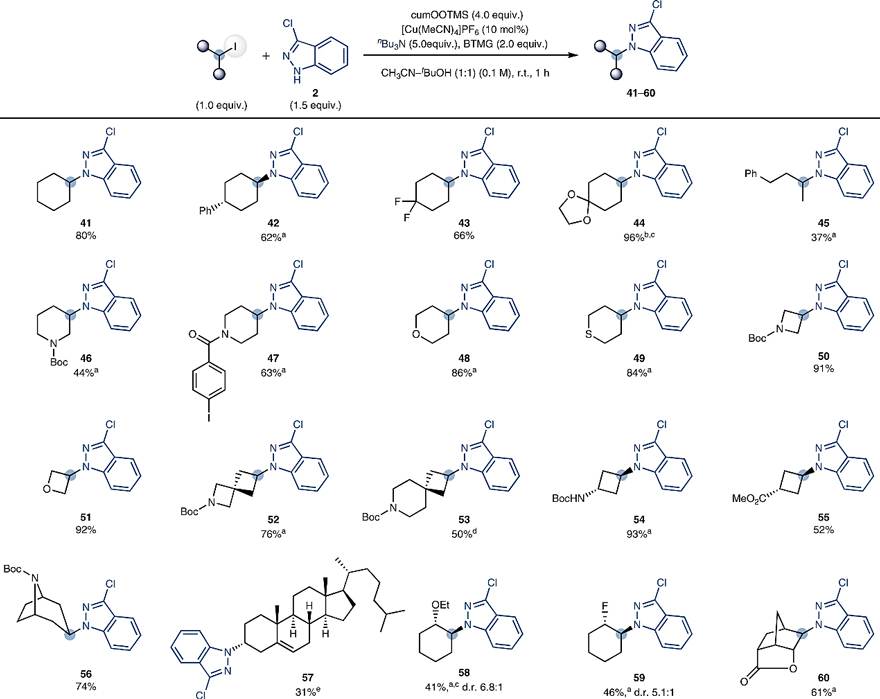
图4. 碘代物的底物探索。图片来源:Nat. Catal.
最后,作者利用该方法对复杂生物活性物质进行了后期N-烷基化修饰(图5)。例如,睡眠褪黑素(61)中的吲哚环能够选择性地进行N-烷基化;肌肉松弛剂美他沙酮(62)与镇咳药芬司匹利(63)都成功地在恶唑烷酮上进行后期N-烷基化修饰。令人惊讶的是,该方法可以完全区分吲哚环与恶唑烷酮的两个亲核位点,从而选择性地得到吲哚的N-烷基化产物(64)。此外,作者还将该方法应用于结构复杂的化合物。比如,免疫调节剂咪喹莫特(65)和抗菌剂甲氧苄啶(66)能以良好至优异的收率获得相应的N-烷基化产物,特别是66在碘代物当量增加的条件下能实现双烷基化。另一方面,抗病毒药物拉米夫定(67)在伯醇与伯胺的存在下,能够选择性地实现伯胺的N-烷基化。类似地,三肽分子(68)与3-碘氧杂环丁烷也能实现这一转化,尽管收率较低(22%)。

图5. 结构复杂分子的后期修饰。图片来源:Nat. Catal.
总结
综上所述,曼彻斯特大学的Daniele Leonori教授和Fabio Juliá教授等研究者将α-氨基烷基自由基介导的XAT过程与铜催化完美结合,为仲烷基碘化物与N-亲核试剂的偶联提供了一种有效的策略。该方法不仅条件温和、底物兼容性好、官能团耐受性好,而且为结构复杂且具有特殊活性的化合物的后期修饰提供了新的策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Copper-catalysed amination of alkyl iodides enabled by halogen-atom transfer
Bartosz Górski, Anne-Laure Barthelemy, James J. Douglas, Fabio Juliá, Daniele Leonori
Nat. Catal., 2021, 4, 623–630, DOI: 10.1038/s41929-021-00652-8
导师介绍
Daniele Leonori
https://www.x-mol.com/university/faculty/2424
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
Science:你若“胺”好,我便“自由” 2020-03-05
-
“灌水”还是“创新”?不一样的视角带你解读Macmillan的Nature新作 2018-07-08
-
光氧化还原和布朗斯特酸共催化实现N-杂环芳烃α-氨基烷基化 2017-04-22
-
无需酸和氧化剂,光氧化还原催化N-杂芳基砜的脱磺烷基化 2019-03-28
-
Nat. Chem.:脂肪胺直接对芳香烃胺化 2019-06-07


































 京公网安备 11010802027423号
京公网安备 11010802027423号