靶向降解转录因子的通用策略:TF-PROTACs
转录因子(Transcription factor)可以促进或者抑制相关基因的转录,基因调控很大程度上依赖于转录因子的表达,它们与包括癌症在内的多种人类疾病密切相关。以转录因子为靶点作为相关癌症的治疗手段蕴含着巨大潜力。由于转录因子缺乏像激酶或者其他蛋白酶等适合底物或者辅助因子的结合位点,因而针对大部分转录因子的小分子抑制剂的开发存在很大困难,导致长时间以来转录因子被认为是不可成药的靶点。
蛋白质水解靶向嵌合体(PROTAC)目前正受到药物研发领域的极大关注。该技术的核心是设计一些具有双重功能的小分子,它们可以同时招募靶蛋白和E3泛素连接酶,在细胞内形成靶蛋白-PROTAC-E3连接酶三元复合物(ternary complex),在空间上将靶蛋白和E3连接酶拉近到合适的距离,从而介导靶蛋白的泛素化,进而经由蛋白酶体被降解。
转录因子的本质是与DNA特异性结合的一系列蛋白质,都具有一个固有的DNA结合结构域(DNA binding domain),会特异性识别并结合一段DNA碱基序列,从而启动相应基因的转录过程。这种高特异性的结合作用为靶向降解转录因子的PROTAC设计提供了很好的工具。美国西奈山伊坎医学院的金坚教授(点击查看介绍)课题组和哈佛医学院的魏文毅教授(点击查看介绍)课题组合作,利用上述转录因子结合域成功开发了针对转录因子的通用靶向降解策略(TF-PROTACs),研究成果发表在J. Am. Chem. Soc.上。

图1. 利用短链DNA特异性降解转录因子的TF-PROTAC策略图示
图1所示为该策略的通用模式。作者合成了一系列不同长度的BCN 修饰的VHL E3连接酶配体(VHLL-X-BCN),以及与靶蛋白转录因子特异性结合的叠氮修饰的短链DNA(N3-ODN)。然后,利用叠氮和环辛炔的“click”反应(SPAAC反应),将两者结合起来,从而得到TF-PROTAC分子。这些分子在进入肿瘤细胞后,就可以招募相应的转录因子,进而介导其降解。作为一项概念性研究成果,作者选择了两个结合域碱基序列比较明确的转录因子,NF-κB和E2F,作为研究的靶蛋白。
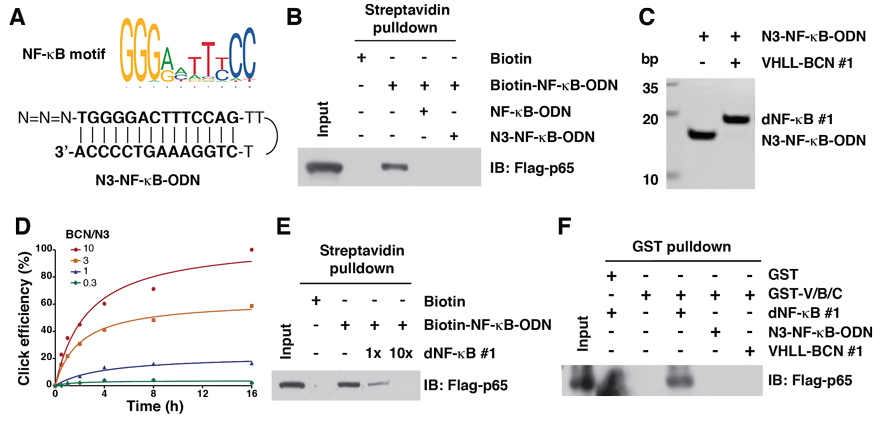
图2. 体外click反应生成靶向NF-κB的TF-PROTAC
作者首先合成了一条单链DNA,序列为5’-TGGGGACTTTCCAGTTTCTGGAAAGTCCCCA-3’(NF-κB-ODN)。序列GGGACTTTCC是NF-κB的结合域。这个单链DNA分子通过退火后形成发卡型双链结构(图2A)。在5’端引入叠氮基团即合成了所需的N3-NF-κB-ODN。作者利用一系列生化试验证实,由N3-NF-κB-ODN形成的TF-PROTAC可以介导三元复合物的形成:(1)作者合成了生物素标记的biotin-NF-κB-ODN,利用生物素-链霉亲和素系统确认其可以结合靶蛋白p65,而过量的NF-κB-ODN或N3-NF-κB-ODN的存在可以竞争性抑制biotin-NF-κB-ODN和p65的结合(图2B)。(2)VHLL-BCN #1和N3-NF-κB-ODN click反应后的产物dNF-κB #1可以很容易滴用20%原生聚丙烯酰胺凝胶电泳进行分离纯化(图2C)。随后,作者测定了不同当量比的条件下click反应发生的效率,可以看到,在环辛炔和叠氮的比例为10:1时,4小时可以得到60%的收率(图2D)。(3)dNF-κB #1可以竞争性抑制biotin-NF-κB-ODN和p65的结合,表明其自身可以结合NF-κB(图2E)。(4)作者表达了重组的GST-VHL蛋白,然后同异常表达p65蛋白的HEK293T细胞裂解液以及dNF-κB #1共同孵育,发现dNF-κB #1可以介导VHL-TF-PROTAC-p65三元复合物的形成(图2F)。
dNF-κB #1虽然介导了VHL-TF-PROTAC-p65三元复合物的形成,但是却没有降解p65(图2F)。作者因而期望通过优化VHLL-BCN中连接链的长度和类型来实现目标蛋白的有效降解。
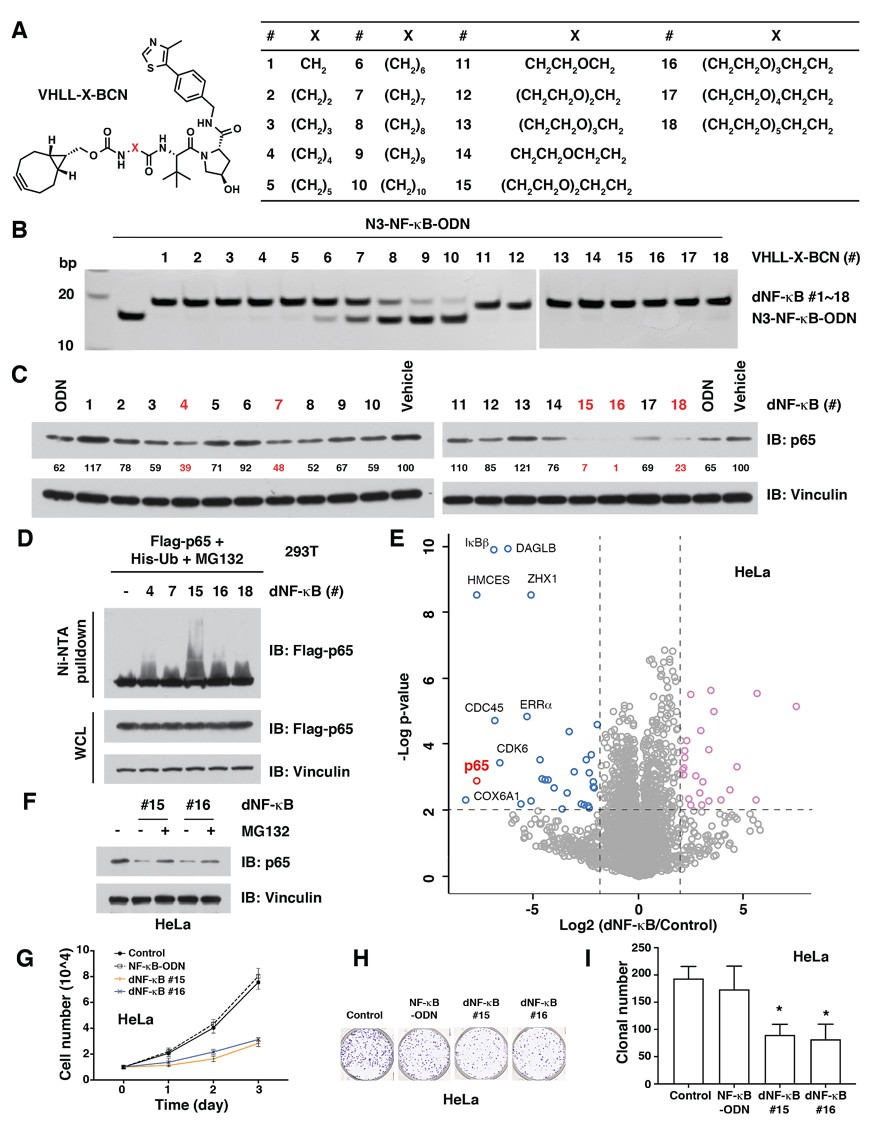
图3. dNF-κB靶向降解细胞内的p65蛋白
图3A所示为作者合成的18种VHLL-BCN连接链,它们分别被用于与N3-NF-κB-ODN的click反应,以获得相应的TF-PROTAC(命名为dNF-κB #1-#18)(图3B)。可以看到,相应的TF-PROTAC都能生成,但是VHLL-BCN #6-#10这五种连接链的click反应效率略有下降。随后,作者将相应的TF-PROTAC(dNF-κB #1-#18)用于HeLa细胞中p65蛋白的降解。有5个TF-PROTAC能将p65蛋白含量降解至天然丰度的50%以下(图3C中红色编号)。这五个TF-PROTAC均能介导p65蛋白的泛素化(图3D)。基于定量质谱的蛋白质组学实验表明,dNF-κB #16处理之后,p65蛋白有非常明显的降解。在可以检测到的4100个蛋白中,有31个蛋白水平有明显降低,其中大部分都与p65联系,如IκBβ、CDK6等。从而进一步证明TF-PROTACTF-PROTAC对p65蛋白的讲解有很好的选择性(图3E)。而在加入蛋白酶体抑制剂MG132或VHL配体(VH-032)之后,dNF-κB #15和#16对p65的降解均被显著抑制,表明p65的降解是通过蛋白酶体和VHL E3连接酶实现的(图3F)。最后,dNF-κB #15和#16显著抑制了HeLa细胞的增殖和形成(图3G-I),然而NF-κB-ODN效果很差,从而说明抑制效果是通过促进NF-κB转录因子的降解而实现的。
随后,为了验证TF-PROTAC策略的普适性,作者开发了基于转录因子E2F的TF-PROTAC(dE2F)。
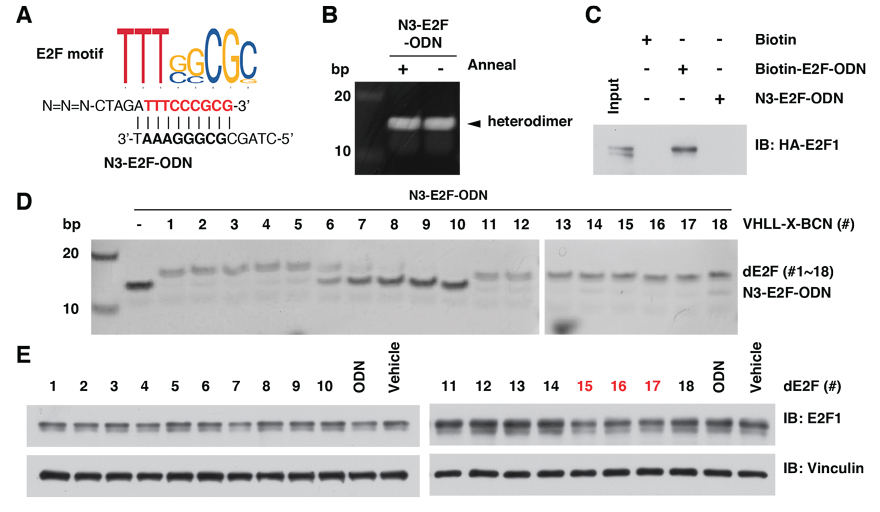
图4. 靶向E2F的TF-PROTAC的设计与合成
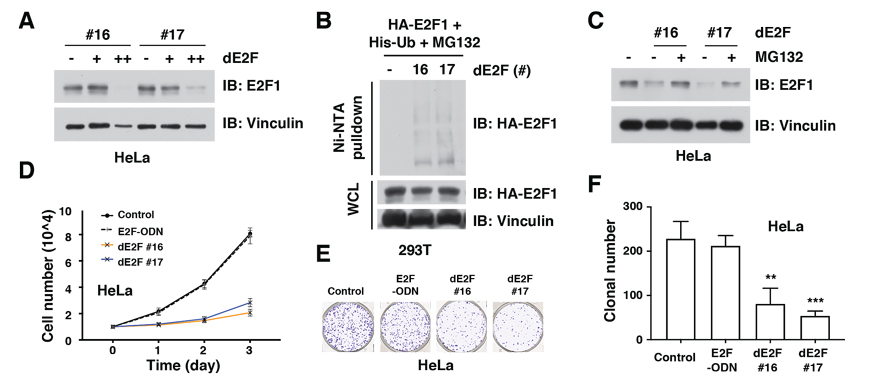
图5. dE2F降解靶向细胞内E2F1蛋白
如图4所示,基于E2F结合域设计的短链DNA N3-E2F-ODN同样能够与VHLL-BCN发生click反应,形成相应的TF-PROTAC(dE2F #1-#18)。其中,dE2F #15、#16、#17均能降解HeLa细胞中的E2F1蛋白。图5则进一步证实了dE2F #16、#17可以在蛋白层面通过泛素化E2F1使其经由蛋白酶体实现降解,还可以显著抑制了HeLa细胞的增殖和形成。
综上所述,作者基于能够与转录因子特异性结合的短链DNA,设计了一类新型PROTAC(TF-PROTAC),它们可以特异性招募对应的转录因子使其降解,从而达到杀灭肿瘤细胞的目的。这项研究突破了转录因子小分子抑制剂的瓶颈,实现传统观念中认为“不可成药”靶点的选择性降解,对于癌症靶向治疗具有重要的意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

TF-PROTACs Enable Targeted Degradation of Transcription Factors
Jing Liu, He Chen, H. Ümit Kaniskan, Ling Xie, Xian Chen, Jian Jin*, and Wenyi Wei*
J. Am. Chem. Soc., 2021, 143, 8902–8910, DOI: 10.1021/jacs.1c03852
导师介绍
金坚
https://www.x-mol.com/university/faculty/311500
魏文毅
https://www.x-mol.com/university/faculty/311501
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
“叶酸笼”-PROTACs策略精准降解癌细胞内靶蛋白 2021-06-12
-
“左右互博”:李华教授等提出双重靶向降解(Dual PROTACs)药物设计新概念 2021-05-30
-
优化PROTAC的新策略:可逆共价 2020-09-07
-
药物版“战神金刚”——首例HDAC6-Proteasome双靶点抑制剂组合成功 2018-12-01
-
《Nature》子刊:利用小分子清除病变蛋白质的新技术 2015-06-15
-
Targeted degradation of CDK9 potently disrupts the MYC-regulated networkMohammed A. Toure, Keisuke Motoyama, Yichen Xiang, Julie Urgiles, Florian Kabinger, Ann-Sophie Koglin, Ramya S. Iyer, Kaitlyn Gagnon, Amruth Kumar, Samuel Ojeda, Drew A. Harrison, Matthew G. Rees, Jennifer A. Roth, Christopher J. Ott, Richard Schiavoni, Charles A. Whittaker, Stuart S. Levine, Forest M. White, Eliezer Calo, Andre Richters, Angela N. Koehler
-
Recent advances in developing targeted protein degradersEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-12-27 ,DOI:10.1016/j.ejmech.2024.117212Binbin Cheng, Hongqiao Li, Xiaopeng Peng, Jianjun Chen, Chuxiao Shao, Zhihua Kong
-
A Kinetic Scout Approach Accelerates Targeted Protein Degrader DevelopmentAngela T. Fan, Gillian E. Gadbois, Hai-Tsang Huang, Charu Chaudhry, Jiewei Jiang, Logan H. Sigua, Emily R. Smith, Sitong Wu, Grace J. Poirier, Kara Dunne-Dombrink, Pavitra Goyal, Andrew J. Tao, William R. Sellers, Eric S. Fischer, Katherine A. Donovan, Fleur M. Ferguson
-
Potential of the nanoplatform and PROTAC interface to achieve targeted protein degradation through the Ubiquitin–Proteasome systemEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-02-01 ,DOI:10.1016/j.ejmech.2024.116168Hanshu Xie, Chao Zhang
-
Transcription Factors in the Pathogenesis of Lupus Nephritis and Their Targeted Therapy.International Journal of Molecular Sciences (IF 4.9) Pub Date : 2024-01-16 ,DOI:10.3390/ijms25021084Kasey M Shao,Wen-Hai Shao


































 京公网安备 11010802027423号
京公网安备 11010802027423号