Tobias Ritter教授近年来工作进展:后期官能团化的“万能钥匙”—芳基噻蒽鎓盐
近年来,后期官能团化(Late-Stage Functionalization,LSF)得到了巨大发展,并广泛应用于药物研发和有机合成方法学中,以实现复杂分子的转化。目前,常见的策略主要有以下几种:催化与非催化反应、C-H键官能团化及其转化、芳基的亲核取代反应以及微生物介导的后期官能团修饰等。

Tobias Ritter教授(左一)及其研究团队。图片来源:Ritter Group
德国马克斯普朗克煤炭研究所的Tobias Ritter教授(点击查看介绍)团队在药物研发和分子影像等多个领域为LSF的发展做出了突出的贡献。迄今为止,他们团队最强大的 LSF 工具无疑是芳基噻蒽鎓盐(aryltetrafluorothianthrenium salts, Ar-TFT+),无需导向基便可高选择性地实现芳基的C-H键官能团化,并且得到的产物还可以进行后续的转化,从而可以构建C-C、C-N、C-O、C-X、C-S等键,堪称一把LSF领域的“万能钥匙”。自2019年Tobias Ritter教授在Nature 报道芳基噻蒽鎓盐化学以来[1](点击阅读详细),短短两年里他们做了许多杰出的工作[2-10]。今天,笔者就和大家聊一聊这把神奇的LSF“万能钥匙”。

一切要从硫叶立德化学(Sulfur Ylide Chemistry)开始说起。上个世纪30年代,Ingold制备了第一例硫叶立德试剂;此后,William Johnson于1961年利用硫叶立德试剂首次实现了9-二甲硫基芴与对硝基苯甲醛之间的反应,合成了环氧亚苄基芴;随后,Corey和Chaykovsky发现了二甲基亚甲基硫叶立德(CH3)2SCH2和另一种亚砜叶立德试剂——二甲基氧代亚甲基硫叶立德(CH3)2SOCH2(Dimethyloxosulfonium methylide),即Corey-Chaykovsky试剂,该试剂可以构建环氧化物、氮杂环丙烷以及环丙烷这类含有三元环结构的有机化合物。迄今为止,科学家发展了各种不同类型的硫叶立德试剂(图1),并将其广泛应用于有机合成化学中,如1,3-偶极环加成、1,5-电环化反应、Johnson-Corey-Chaykovsky反应、X-H键插入反应、环加成反应、重排反应等。

图1. 不同类型的硫叶立德试剂。
2019年,Tobias Ritter教授利用四氟噻蒽亚砜和催化量的四氟噻蒽原位形成四氟噻蒽鎓阳离子自由基(Ar-TFT+),后者与芳烃形成双阳离子加合物,不可逆地脱质子后便得到一种新型的硫叶立德试剂——芳基噻蒽鎓盐(图2)[1]。与常规的溴化、硼酸酯化等过程相比,芳基噻蒽鎓盐的区域选择性大大提高,并在后期官能团化中显现出强大的反应活性,可进一步用于Suzuki偶联、Sonogashira偶联、Negishi偶联、Heck反应、羰基化、硼酸酯化、氯化、碘化、氰化、光催化等多种转化(图3)。自此,Tobias Ritter教授开发了一系列不同的噻蒽鎓盐,并在构建C-C键、C-N键、C-O键、C-X键等方面做出了一系列不同的贡献。
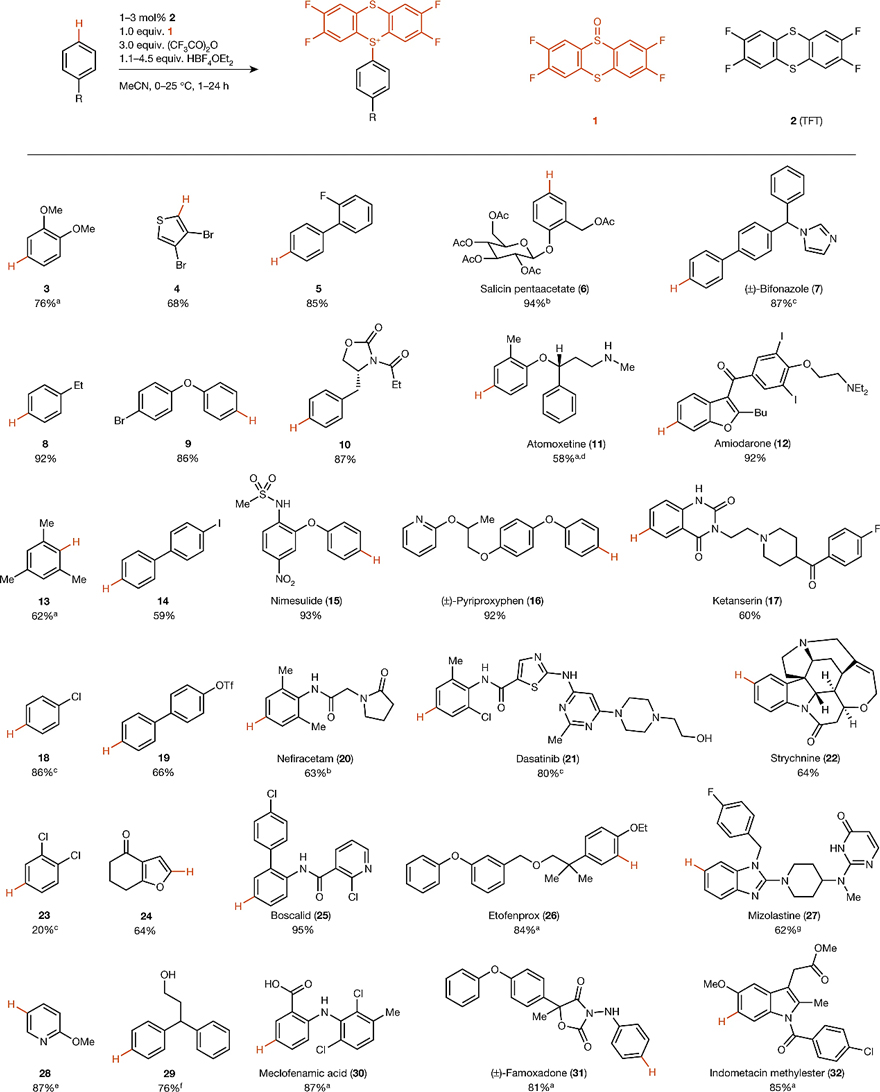
图2. 芳基噻蒽鎓盐合成。图片来源:Nature [1]

图3. 万能的芳基噻蒽鎓盐。图片来源:Nature [1]
1. 芳基噻蒽鎓盐选择性构建碳-氟/碳-三氟甲基
有机氟化物具有特殊的物理化学性质,广泛存在于天然产物和药物分子中,并在医药、材料等领域中具有重要的应用。然而,要想实现后期位点选择性 C-F 键的构建仍颇具挑战。为此,Ritter教授利用光氧化还原催化成功地实现了芳基噻蒽鎓盐的后期位点选择性 C-F 键构建(图4) [2] 和芳烃的位点选择性后期[18F]氟化(图5)[3]。

图4. 光催化芳基噻蒽鎓盐选择性构建碳-氟键。图片来源:Nat. Chem. [2]
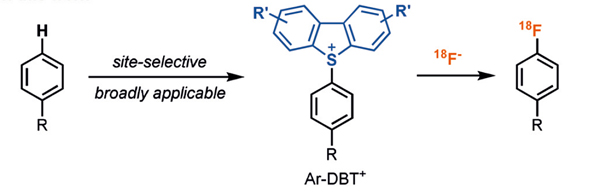
图5. 芳基噻蒽鎓盐选择性构建碳-氟键。图片来源:Angew. Chem. Int. Ed. [3]
此外,由于三氟甲基的特殊性质(如增强分子的脂溶性、提高代谢稳定性、提高分子的抗氧化性和刚性等),含有三氟甲基的化合物广泛应用于制药和材料领域中。迄今为止,已有超过65种含有三氟甲基的药物获得美国FDA批准,因此化学家们致力于开发含有三氟甲基化合物。2019年,Ritter教授团队在铜/光氧化还原的共同催化下,经由芳基硫盐实现了芳环选择性碳-三氟甲基的构建(图6)[4](点击阅读详细)。

图6. 光介导芳基噻蒽鎓盐选择性构建碳-三氟甲基。图片来源:Angew. Chem. Int. Ed. [4]
目前,三氟甲基化学的发展离不开三氟甲基试剂,而大多数亲电三氟甲基化试剂都是基于高价碘或硫化物(如Togni试剂I/II、Umemoto试剂等,图7)。事实上,三氟甲基反应大多是经历以下三种历程(即CF3–、CF3·和CF3+),并且目前尚未开发出同时具有以上三种特性的三氟甲基试剂。值得一提的是,Ritter教授团队利用噻蒽(TT)与三氟甲磺酸酐成功地合成了一种新型的三氟甲基试剂——TT-CF3+OTf–(图8)[5](点击阅读详细),并以Cu介导芳基硼酸的偶联反应、光介导CF3·对杂环的取代反应、硫醇/硫酚的三氟甲基化反应、烯烃的氢化三氟甲基化反应、酮的亲核三氟甲基化以及1,3-二酮的亲电三氟甲基化等六种反应展示了该试剂同时具有亲电、亲核和自由基反应特性(图9),是一种全能的三氟甲基试剂,在三氟甲基化合物的合成中展现出巨大的潜力。

图7. 三氟甲基试剂。图片来源:J. Am. Chem. Soc. [5]
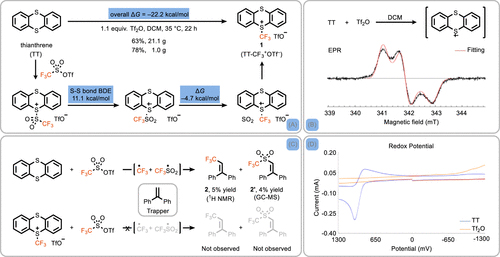
图8. 新型三氟甲基试剂的合成。图片来源:J. Am. Chem. Soc. [5]

图9. 新型三氟甲基的三种反应性。图片来源:J. Am. Chem. Soc.[5]
2. 芳基噻蒽鎓盐选择性构建碳-氧键
作为有机化学中最常见的化学键之一,碳氧键广泛存在于聚合物、合成中间体以及药物分子中。迄今为止,化学家在构建芳基C-O键方面做出了许多突出的贡献,比如 Vilsmeier–Haack 甲酰化、Dakin 氧化、Sandeyer羟基化、Ullmann-type reactions、Chan–Lam Taken等,但是这些方法都无法在普遍意义上进行区域选择性氧化,除非有机分子先进行预官能团化。2019年,Ritter教授团队以水或者醇为亲核试剂,通过光氧化还原与过渡金属共催化芳基噻蒽鎓盐,高位点选择性地合成了一系列苯酚及芳醚衍生物(图10)[6](点击阅读详细)。

图10. 芳基噻蒽鎓盐选择性构建碳-氧键。图片来源:Angew. Chem. Int. Ed. [6]
3. 芳基噻蒽鎓盐选择性构建碳-氮键
含氮基团通常可以改善潜在候选药物的药理特性。如果在后期引入胺和含氮杂环,就可以避免多步合成的保护基干扰。目前,构建C-N键的方法主要有以下两种:1)Pd、Cu、Ni等过渡金属催化芳烃和含氮亲核试剂的交叉偶联(如Pd催化的Buchwald-Hartwig偶联反应、Cu催化的Ullmann偶联、Chan-Lam偶联反应、光氧化还原/Ni双催化体系、电化学辅助的Ni催化体系);2)C-H键活化胺化。然而,这两种方法仍存在一定的局限性,如芳烃需要预先官能团化、含氮亲核试剂有限、无法兼容结构复杂的分子、导向基团以及导向基团选择性不好等。在此基础上,Ritter教授团队基于芳基噻蒽鎓盐,发展了一种高立体选择性构建C-N键的方法(图11)[7],并设计了两种Pd催化体系和两种光氧化还原/Cu双催化体系,成功地实现了芳香烃与一系列脂肪胺、芳香胺甚至含氮杂环的C-N键交叉偶联。另外,Ritter教授设计并合成了一种新型的噻蒽鎓盐——Iminothianthrenes,并在光催化的作用下成功地实现了烯丙基的C-H键胺化反应(图12)[8]。

图11. 芳基噻蒽鎓盐交叉偶联构建碳-氮键。图片来源:J. Am. Chem. Soc. [7]
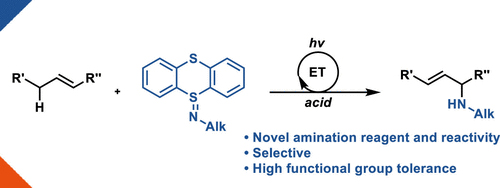
图12. 烯丙基C-H胺化反应。图片来源:J. Am. Chem. Soc. [8]
4. 芳基噻蒽鎓盐选择性构建碳-碳键
近年来,过渡金属催化的C(sp2)-C(sp3)交叉偶联反应在有机合成化学中起到越来越重要的作用,为合成天然产物、药物分子、生物活性分子等提供了一种重要手段。尽管如此,现有方法仍存在一定的缺陷(如位点选择性较差、需要预官能团化等等)。为此,Ritter教授团队通过两步无导向区域选择性C-H键官能团化/还原烷基化策略(图13)[9],实现了芳基噻蒽鎓盐与简单易得的烷基碘化物之间的C(sp2)-C(sp3)交叉偶联反应,制备了一系列不同烷基取代的芳烃和结构复杂的药物分子。该策略不仅具有很好的选择性,而且反应条件温和、官能团耐受性好,为复杂分子的后期官能团化提供了一种简单高效的方法。随后,Ritter教授团队通过α-氨基烷基自由基活化芳基噻蒽鎓盐,获得了一系列不同的杂芳基化合物(图14)[10],并且无需金属催化剂、光照以及惰性气氛。

图13. 芳基噻蒽鎓盐选择性构建碳-碳键。图片来源:J. Am. Chem. Soc. [9]

图14. α-氨基烷基自由基活化芳基噻蒽鎓盐。图片来源:Angew. Chem. Int. Ed. [10]
导师介绍
Tobias Ritter
https://www.x-mol.com/university/faculty/50250
相关链接:
1. Berger, F. et al. Site-selective and versatile aromatic C−H functionalization by thianthrenation. Nature, 2019, 567, 223-228, DOI:10.1038/s41586-019-0982-0
2. Li, J. et al. Photoredox catalysis with aryl sulfonium salts enables site-selective late-stage fluorination. Nat. Chem., 2020, 12, 56-62; DOI: 10.1038/s41557-019-0353-3
3. Xu, P. et al. Site-Selective Late-Stage Aromatic [18F]Fluorination via Aryl Sulfonium Salts. Angew. Chem. Int. Ed., 2020, 59, 1956-1960; DOI: 10.1002/anie.201912567
4. Ye, F. et al. Aryl Sulfonium Salts for Site-Selective Late-Stage Trifluoromethylation. Angew. Chem. Int. Ed., 2019, 58, 14615-14619; DOI: 10.1002/anie.201906672
5. Jia, H., Häring, A. P., Berger, F., Zhang, L. & Ritter, T. Trifluoromethyl Thianthrenium Triflate: A Readily Available Trifluoromethylating Reagent with Formal CF3+, CF3·, and CF3– Reactivity. J. Am. Chem. Soc., 2021, 143, 7623-7628; DOI: 10.1021/jacs.1c02606
6. Sang, R. et al. Site-Selective C−H Oxygenation via Aryl Sulfonium Salts. Angew. Chem. Int. Ed., 2019, 58, 16161-16166; DOI: 10.1002/anie.201908718
7. Engl, P. S. et al. C–N Cross-Couplings for Site-Selective Late-Stage Diversification via Aryl Sulfonium Salts. J. Am. Chem. Soc., 2019, 141, 13346-13351; DOI: 10.1021/jacs.9b07323
8. Cheng, Q., Chen, J., Lin, S. & Ritter, T. Allylic Amination of Alkenes with Iminothianthrenes to Afford Alkyl Allylamines. J. Am. Chem. Soc., 2020, 142, 17287-17293; DOI: 10.1021/jacs.0c08248
9. Lansbergen, B., Granatino, P. & Ritter, T. Site-Selective C–H alkylation of Complex Arenes by a Two-Step Aryl Thianthrenation-Reductive Alkylation Sequence. J. Am. Chem. Soc., 2021, 143, 7909-7914; DOI: 10.1021/jacs.1c03459
10. Alvarez, E. M., Karl, T., Berger, F., Torkowski, L. & Ritter, T. Late-Stage Heteroarylation of Hetero(aryl)sulfonium Salts Activated by α-Amino Alkyl Radicals. Angew. Chem. Int. Ed., 2021, 60, 13609-13613; DOI: 10.1002/anie.202103085
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号