PET成像技术用于免疫治疗效果预测
近年来,以免疫检查点抑制剂(Immune-checkpoint inhibitors, ICIs)为代表的癌症免疫疗法掀起了一场癌症医学革命。免疫检查点抑制剂的主要作用是解除免疫系统的“刹车”,恢复免疫系统对癌细胞的追杀。在过去的10余年,已有上10种免疫检查点抑制剂获批上市,同时,免疫检查点抑制剂的适应症还在不断拓展,目前,免疫检查点治疗被证实在黑色素瘤、肺癌、肾癌、结直肠癌等多种类型的肿瘤中有效。更为重要的是,该疗法在使用传统抗癌方案无效的多种中晚期恶性肿瘤中也表现出显著并持久的抗肿瘤效果。尽管如此,免疫检查点治疗仍面临诸多问题,如患者响应率低。根据临床数据,大约只有30%左右的病人可以从ICI中持久获益。因此,亟需开发疗效预测方法来帮助识别潜在的获益人群,指导临床对此类药物的合理使用。
吲哚胺2,3-双加氧酶1 (IDO1) 是催化色氨酸代谢的关键限速酶,其广泛分布在哺乳动物的组织和器官中。在健康组织中,IDO1催化色氨酸分解代谢,调控机体免疫稳态,避免免疫系统过度激活对健康细胞造成损伤。但是,在恶性肿瘤中,IDO1的表达上调,导致色氨酸耗竭和下游产物积累,使杀肿瘤的效应T细胞 (Teff) 和自然杀伤 (NK) 细胞被抑制,免疫抑制的调节性T 细胞 (Treg) 被激活,从而构建了一个局部的免疫抑制微环境,最终使得癌细胞逃避免疫系统攻击。研究表明IDO1在多种癌细胞如乳腺癌、宫颈癌、脑癌等上调表达,与肿瘤的恶性度及患者的不良预后密切相关。因此,IDO1成为了免疫调节药物研发中最热门的靶点之一,开发针对IDO1的抑制剂成为了癌症免疫治疗的新策略。在过去的数十年里,已有数千种选择性的IDO1抑制剂被报道。大量的临床前数据表明IDO1抑制剂可使免疫系统重新激活,呈现出显著的抗癌效能,且无明显的毒副作用。一时间,IDO1抑制剂的临床实验如火如荼展开,许多药企巨头,纷纷加码IDO1抑制剂的研发。然而,在Incyte公司于2018年公布的一项三期临床(ECHO-301)数据中,使用IDO1抑制剂epacadostat与抗PD-1抗体的联合治疗方案未获得预期效果。此次失败,使得IDO1抑制剂的临床实验遭遇了迅速“冷场”,大公司纷纷撤销或放弃关于IDO1抑制剂的临床实验。IDO1临床实验的失败,让药物学家们反思究竟是什么原因导致了这种现象?IDO1抑制剂究竟是否有效?如何预测IDO1抑制剂的治疗效果?什么样的策略可能会挽救这些研发?
带着上述问题,日本国立研究开发法人量子科学技术研究开发机构(以下简称“量研”)量子生命•医学部门量子医科学研究所张明荣教授团队近年来在癌症免疫治疗效果预测、影像指导的癌症免疫治疗等方向开展了详实的工作。其团队在过去数年,开发了多个正电子发射计算机断层扫描成像(PET)药物,用于癌症免疫治疗个体筛选或者疗效预测。近日,其团队在国际期刊Journal for ImmunoTherapy of Cancer 在线发表了一项最新的研究进展——通过肠系膜淋巴结中IDO1的表达量预测免疫治疗的效果。
目前,在免疫检查点抑制剂治疗中,肿瘤组织中免疫检查点蛋白的表达量是预测治疗效果的指标之一。例如,PD-L1蛋白的表达量可用于预测Opdivo等免疫检查点抑制剂(抗PD-1抗体/抗PD-L1抗体)的治疗效果。基于此,科学家们思考是否可以通过解析肿瘤组织中IDO1的表达信息,来预测IDO1抑制剂的治疗效果。然而,不同于PD-L1蛋白,IDO1的表达及活性受多种因素影响,如代谢和免疫调控。因此,通过肿瘤组织中IDO1表达量来预测IDO1抑制剂治疗效果是行不通的。然而,考虑到抗肿瘤免疫是一种全身性的反应,且IDO1在正常组织中的表达与自身的免疫防御机制有关。因此,研究人员大胆设想:通过可视化非肿瘤区域的IDO1表达可以预测IDO1抑制剂的免疫疗效。
为了验证上述设想,研究人员首先开发了一种与IDO1结合的 PET 药物 (11C-L-1MTrp,图1A),并证实了11C-L-1MTrp 可特异性结合IDO1,可视化小鼠肿瘤内的IDO1蛋白(图1B)。随后,研究人员使用11C-L-1MTrp-PET对接受了IDO1抑制剂+化疗药物(紫杉醇或者环磷酰胺)的2种联合方案治疗的荷恶性黑色素瘤的小鼠行全身成像。结果显示:11C-L-1MTrp在肿瘤中的富集不能反映联合治疗的效果差异。然而,研究者们发现,在治疗效果较好的小鼠中,11C-L-1MTrp显示出特异性的肠系膜淋巴结高摄取(图1C-1E),这一结果意味着肠系膜淋巴结中的IDO1表达量是预测IDO1抑制剂联合治疗效果的指标。
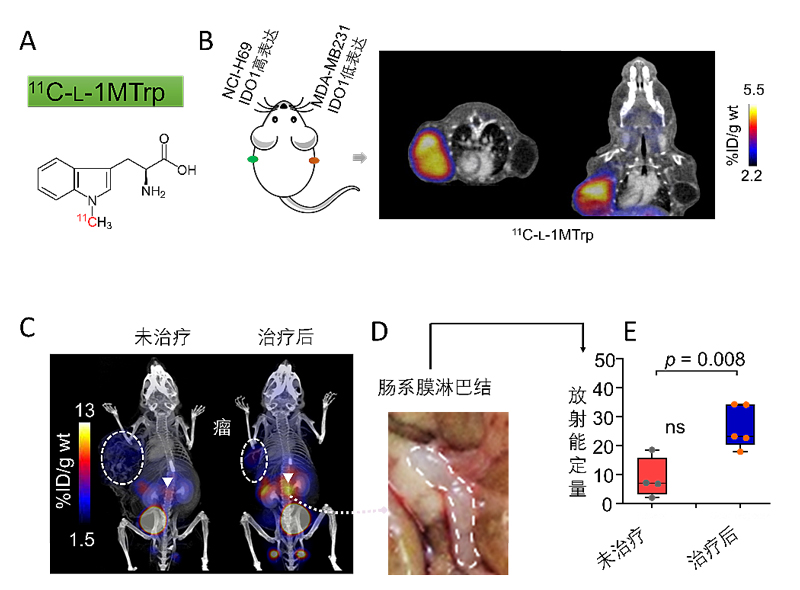
图1. A) PET药物11C-L-1MTrp的结构。B) 荷瘤裸鼠的PET显像图。C)荷恶性黑色素瘤的全身PET成像。D)肠系膜淋巴结的解剖示意图。E)肠系膜淋巴结中11C-L-1MTrp的放射能。图片改编自J. Immunotherapy Cancer。
基于上述发现,研究人员进一步使用11C-L-1MTrp-PET对接受IDO1抑制剂联合治疗(L-1MTrp + 环磷酰胺)的小鼠进行了长程追踪。通过对治疗前,治疗中和治疗后的小鼠进行成像,研究者发现小鼠的肠系膜淋巴结中的11C-L-1MTrp蓄积可以完美的预测全身性抗肿瘤免疫响应,从而为个性化用药提供指导。
随后,为了验证11C-L-1MTrp-PET成像预测免疫治疗效果的普适应,研究人员使用第3种免疫检查点联合疗法配方(抗PD-1抗体+抗CTLA-4抗体+环磷酰胺)对荷恶性黑色素瘤的小鼠进行治疗,并对所有小鼠行11C-L-1MTrp-PET成像。在治疗终点,研究人员根据肿瘤的大小对小鼠进行疗效分组(治疗有效组与治疗失败组)。结果表明:治疗有效组的老鼠的肠系膜淋巴结中的11C-L-1MTrp-PET摄取远高于治疗失败组,相关性分析显示,肠系膜淋巴结中的11C-L-1MTrp摄取与肿瘤大小变化率呈现高度的负相关,即抗癌治疗效果越好,肠系膜淋巴结中的11C-L-1MTrp的摄取越高(图2)。
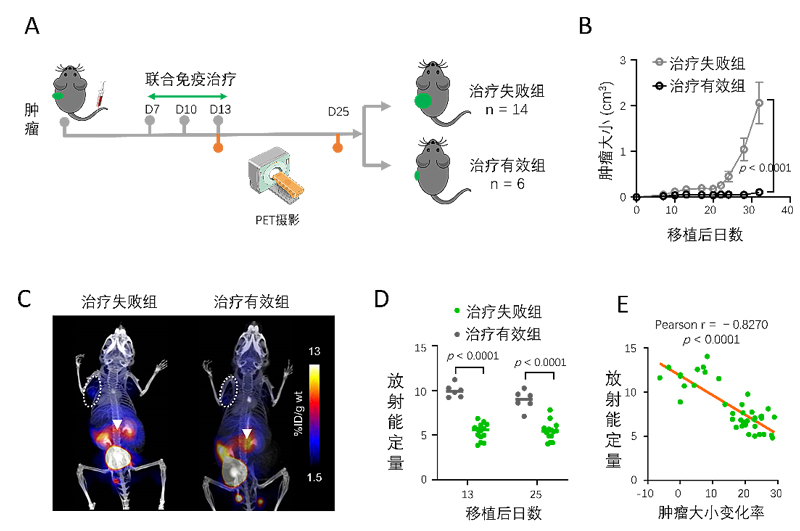
图2. A) 实验方案示意图。B)肿瘤生长曲线。C)治疗失败组和治疗有效组小鼠的全身PET图像。D)肠系膜淋巴结中的放射能。E)肿瘤大小变化率与肠系膜淋巴结中的放射能的相关性曲线。图片改编自J. Immunotherapy Cancer。
上述结果表明肠系膜淋巴结中11C-L-1MTrp的蓄积量(即IDO1的表达量)不仅可以作为预测IDO1抑制剂联合治疗方案的效果,而且还可以预测免疫检查点抑制剂的免疫治疗效果。据可查到的资料显示,该项成果是迄今第一项关于通过瘤外靶点的显像预测抗肿瘤免疫治疗效果的报道。该技术有望帮助更好的理解IDO1的生物特性,构建合理的联合治疗策略,从而挽救IDO1抑制剂的研发。同时,该技术还可以应用于免疫治疗早期对癌症免疫疗法的受益人群进行筛选,推动个性化免疫联合治疗的发展。为了实现这一目标,张教授团队表示正在考虑在临床试验中验证这项技术的可行性,并评估其作为预测免疫治疗效果的实际价值。
该成果于近日发表在免疫治疗学期刊Journal for ImmunoTherapy of Cancer 上。文章的共同第一作者为日本国立量研机构谢琳主任研究员、胡宽研究员和瑞典卡罗琳斯卡医学院朵燕红博士,日本国立量研机构张明荣教授为论文的第一通讯作者,卡罗琳斯卡医学院曹义海教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Off-tumor IDO1 target engagements determine the cancer- immune set point and predict the immunotherapeutic efficacy
Lin Xie, Kuan Hu, Yanhong Duo, Takashi Shimokawa, Katsushi Kumata, Yiding Zhang, Cuiping Jiang, Lulu Zhang, Nobuki Nengaki, Hidekatsu Wakizaka, Yihai Cao and Ming-Rong Zhang
J. Immunotherapy Cancer, 2021, 9, e002616, DOI: 10.1136/jitc-2021-002616
部分作者介绍
张明荣教授,现任日本国立量研机构量子生命•医学部门量子医科学研究所先进核医学基础研究部部长,同时担任日本东北大学、横滨市立大学、中国南京医科大学、暨南大学等客座教授。至今已在Nature Medicine, Nature Neuroscience, Nature Communications, Journal of Hepatology, Neuron, Brain, Journal of Nuclear Medicine, European Journal of Nuclear Medicine and Molecular Imaging, Journal of Medicinal Chemistry,Theranostics等期刊发表论文300余篇,主持或参与日本内阁府、日本医疗研究开发机构等的大型科研经费数十项。主要研究方向包括:PET分子探针标记与制备新技术的研发、新型PET和靶向核素偶联药物的研发以及致力于为临床研究提供更高品位的放射性药物。张教授团队成功向临床转化PET药物近40种,涉及包括多巴胺D4受体、乙酰胆碱酯酶、sigma-1受体、NMDA受体、5-羟色胺转运体、5-羟色胺受体5-HT7、转位蛋白TSPO、Pgp-Bcrp、大麻素受体CB1和CB2、代谢型谷氨酸受体亚型1和亚型5、脂肪酸酰胺水解酶FAAH、单酰基甘油酯酶MAGL等在内的数十余个与神经、精神系统疾病、肿瘤密切相关的靶点。
谢琳,大阪大学医学博士。现任日本国立量研机构量子生命•医学部门量子医科学研究所先进核医学基础研究部主任研究员。主要研究方向为PET探针的开发与疾病诊断、靶向α核素药物开发与临床转化。至今在Journal of Hepatology,Journal for ImmunoTherapy of Cancer, Journal of Nuclear Medicine,Journal of Medicinal Chemistry,Nature Communications等期刊发表论文80余篇。共主持JSPS等科学研究项目13项,以科研主干参与日本内阁府研究项目等11项。曾荣获世界分子影像学会青年科学家奖、日本核医学会研究奖励奖、武田科学振兴财团医学研究奖励奖等荣誉10余项。
胡宽,北京大学博士。现任日本国立量研机构量子生命•医学部门量子医科学研究所先进核医学基础研究部研究员。主要研究方向包括:多肽药物与核药的开发与临床转化、分子影像与核医学、生物材料。至今在Nature Communications, Science Advances, Angewandte Chemie International Edition, Coordination Chemistry Reviews, Small, Journal for ImmunoTherapy of Cancer, CCS Chemistry,Nano Energy 等期刊发表论文50余篇等。申请中国专利12项,授权8项;日本专利1项。主持日本JSPS基盘研究B等科研项目7项;参与日本内阁府研究项目等共6项。曾荣获得北京大学优秀博士论文、国际放药协会JLCR青年科学家奖、中美核医学与分子影像会议青年科学奖、中日韩放射性药物会议青年科学家奖等若干奖项。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号